新型鋰離子電池正極材料LiV1-XFexO2的合成及電化學性能研究
http://m.51xinxi.cn/mall/zhengjicailiao/新型鋰離子電池正極材料LiV1-XFexO2的合成及電化學性能研究
冉淇文1 胡友作1 舒小會1 張美玲1 劉珊珊1 譚銘1 劉興泉*1,2
1. 電子科技大學材料與能源學院,四川成都610054
2. 四川富驊新能源科技有限公司,四川綿陽621006
摘要:LiVO2及其衍生物是一類重要的鋰離子電池電極材料,隨著其組分的不同和嵌脫鋰電壓的高低,可以分別作為鋰離子電池的正極材料和負極材料使用,單純的LiVO2材料由于其嵌脫鋰電壓較低,絕大多數作為負極材料進行了研究。但是當LiVO2其中摻入某些金屬離子后,其嵌脫鋰電壓會有顯著上升,故其可以作為潛在的鋰離子電池正極材料進行研究。本文簡述了LiVO2及其衍生物的微觀結構、電化學性質、碳熱還原法制備LiVO2的原理。并結合自己的工作考察了不同釩源、不同鋰源對制備LiVO2材料結構的影響;考察了不同鋰源、不同釩源和不同碳包覆量對制備的LiVO2材料電化學性能的影響,并最終確定了最佳的鋰源、釩源和碳包覆量。
Synthesis and electrochemical properties of LiV1-xFexO2 used as new cathode materials of lithium-ion batteries
Ran Qi-wen1, HU You-zuo1, SHU Xiao-hui1, ZHANG Mei-ling1, LIU Shan-shan1, TAN Ming1, LIU Xing-quan*1,2
1. School of Materials and Energy, University of Electronic Science and Technology, Chengdu 610054, Sichuan, China.
2. Sichuan Fuhua New Energy High-Tech Co., Ltd., Mianyang 621006, Sichuan, China.
Abstract: LiVO2 and its derivatives are a kind of important electrode materials of lithium-ion secondary batteries, with the difference of components and lithium-ion intercalation/ deintercalation voltage, they can be used as cathode or anode materials. Because the pure LiVO2 material has lower voltage plateau, it is usually used as anode material and studied broadly by many researchers. But when it is doped by certain other metal ions, its lithium-ion intercalation/ deintercalation voltage will be lifted obviously, therefore, it can be used as cathode material of lithium-ion batteries and will get wide researches. In this paper, the structure, electrochemical performances, preparation principle of carbothermal synthesis of LiVO2 and its derivatives were summarily described. In terms of ourselves’ work, the effects of different vanadium sources and different lithium sources on the structures of LiVO2 material were investigated; the influences of different lithium sources and different vanadium sources as well as different coated carbon contents on the electrochemical properties of LiVO2 material were investigated. Finally, the optimum lithium sources and vanadium sources as well as coated carbon contents were determind.
Keywords: Lithium-ion batteries, Cathode material, Anode material, LiVO2, Iron doping.
0 引言
LiVO2及其衍生物是一類重要的鋰離子電池電極材料,隨著其組分的不同和嵌脫鋰電壓的高低,可以分別作為鋰離子電池的正極材料和負極材料使用,單純的LiVO2材料由于其嵌脫鋰電壓比較低,絕大多數作為負極材料進行了研究。但是當LiVO2其中摻入某些金屬離子后,其嵌脫鋰電壓會有顯著上升,故其可以作為潛在的鋰離子電池正極材料進行研究。本文擬對鐵離子摻雜的LiVO2材料進行考察,并將其作為鋰離子電池的正極材料,分別研究其制備工藝和電化學性能。
1 LiVO2的微觀結構
過渡金屬V離子具有(+2、+3、+4、+5)多個價態,可以形成多種化合物:如LiV3O8, g-LiV2O5、LiV2O4、LiVO2等。其中LiVO2為層狀化合物,并且具有α-NaFeO2結構,屬于斜方晶系,空間群為R3m,晶胞參數為a=0.283nm、b=1.487nm,LiVO2呈立方密堆積,氧陰離子處于6c位置,Li+和V3+分別處在立方密堆積氧陰離子之間的八面體位置(3a, 3b)的交替層上。LiVO2的宿主為VO2為層狀結構,它是由中間夾著V原子的兩組O原子面組成的一個夾心層,層與層之間靠范德瓦耳斯力結合,層與層之間可以插入不同的客體離子,其晶體結構如圖1所示。
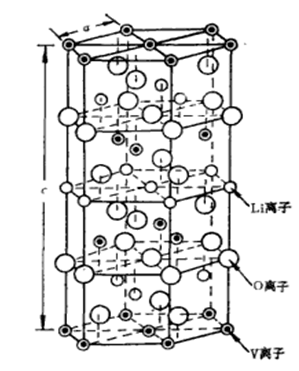
在充放電的過程中,隨著Li+的脫出晶格中的a值增大,c值減小導致立方密堆積層晶格里的V離子將重新排列,當材料過度脫鋰的情況下,V離子會進入到鋰層,進而占據鋰離子脫出后而遺留的空位,導致材料的不可逆相變而引起容量的衰減,而Li+全部脫出時V離子此時的價態接近正4價。LiVO2在XRD圖譜中主要由(003)和(104)兩個譜線來表征,而(003)線的強度大于(104)線的強度時表明LiVO2是單相結構。在LixVO2化合物里,只有出現八面體3b位置上的V離子遷移到共用面3a空位置上去的情況下,才能引起材料的結構相變,并且x值越小,V離子占據3a位置的幾率越大,越容易發生材料的結構相變。當x>0.7的時候,(003)線的強度大于(104)線材料,仍然是單相結構。當0.5 <x<0.7,的時候,(003)線的強度小于(104)線強度表面材料是二相結構。
如果對LiVO2正極材料進行摻雜過渡金屬離子時(比如Fe3+),通過對材料的XRD精修處理可以得到:隨著摻雜量的提高,a值增加、c值減小、Li-O鍵的鍵長縮短、Fe-O鍵的鍵長增加、O1-Li-O2和O1-Fe-O2的角度增大、FeO2層的厚度會增加、插層的層間距會縮短,同時由于Fe3+與V3+的離子半徑相似可能會促使粒子的顆粒增大。
2 LiVO2的電化學性質
LiVO2及其衍生物電極材料既可以作為正極材料,也可以作為負極材料并且有著不同的電化學性能。當LiVO2富鋰化即形成Li1+xV1-xO2結構時作為負極材料具有電壓平臺低、體積能量密度高(大約是石墨的兩倍)等優異的特點。當LiVO2貧鋰化即形成Li1-xVO2作為正極材料展示出了優異的電化學性能。由于和LiCoO2等一樣具有α-NaFeO2結構,因此作為正極材料具有很好的電化學性能是可以預見的,但是在鋰離子的脫嵌過程中兩者之間還是有一些明顯的區別。比如LiCoO2在脫鋰的過程中是一個單相的過程并且放電平臺大約在3.5V左右,而LiVO2正極材料放電的過程中往往伴隨著不可逆相變同時平臺電壓接近3V。對于LiVO2正極材料在鋰離子的脫出和嵌入的過程中,V離子往往會占據鋰離子脫出后遺留的空位,導致鋰離子擴散通道被阻塞從而降低了材料的電化學性能。這個問題可以通過3種方法來抑制:用Fe3+或者Cr3+來取代V離子、制備具有無序結構的LixVyO2促使Li和V離子隨機分布、將顆粒降低到納米級。有研究表明,V離子被其他的過渡金屬元素替代(如:Fe、Cr、Mo等)可以顯著的提高材料的電化學性能,其中Fe摻雜可以提高材料的倍率性能,Cr摻雜可以提高材料的循環性能。
3 碳熱還原法制備LiVO2的原理
碳熱還原法(CTR)一般在冶金工業上應用較多,其原理是利用C-O鍵的結合力,在高溫下發生氧化還原反應。碳熱還原法的制備方法簡單并且成本較低,因此碳熱還原法是一種非常適合工業化的方法。利用碳熱還原方法制備的LiVO2的主要得化學反應方程式如下: 2LiOH + V2O5 + C → 2LiVO2 + CO2 + H2O 首先將鋰鹽、釩氧化合物與過量的碳或者含碳有機物按照化學計量比充分混合,然后在惰性保護氣體的條件下高溫固相反應得到最終產物。同時C源不僅可以把V5+還原到V3+還可以在表面包覆碳提高材料的電導率和抑制晶體顆粒的變大。
4 實驗部分
材料的制備:將過量5%的鋰源(LiOH, Li 2CO3)、釩源(V2O5,NH4VO3)和蔗糖(C12H22O11)按嚴格化學計量比2.1或者1.05 : 1: (1+x%)充分均勻混合,在無水乙醇介質中研磨成為漿態狀物料,將流變態的物料干燥,然后在惰性氣氛(N2)下500°預燒5h,再于750度保溫12h,最終獲得產物。
5 材料的結構表征
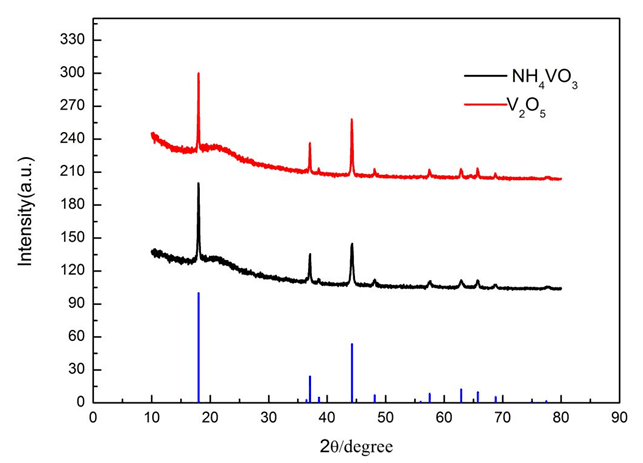
圖2分別為以V2O5和NH4VO3為釩源制備得到的最終樣品的XRD圖譜,從圖中可以發現,不同釩源制備的樣品,其XRD衍射特征峰的峰形基本一致,無其他雜相,都具有α-NaFeO2結構,屬于R3m空間群,層狀結構的特征峰(003)和(104)衍射峰均比較明顯,且(003)峰的峰強明顯大于(104)峰的峰強,說明層狀結構發育良好。但從圖中可以發現以V2O5為釩源的樣品的特征峰更加尖銳,可能是由于NH4VO3分解后的產物V2O5活性不高導致,故釩源選擇V2O5最佳。
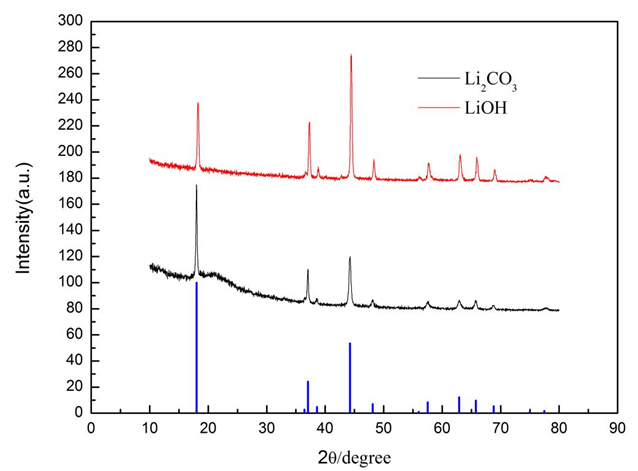
圖3為不同鋰源得到的樣品的XRD衍圖譜,從圖中可以發現,不同的鋰源制備的LiVO2衍射峰形和標準的PDF卡片一致,均無雜相,都具有α-NaFeO2結構,屬于R3m空間群,但是以Li2CO3為鋰源的LiVO2(003)峰的峰強明顯強于(104)峰,說明層狀結構發育良好,但是以LiOH為鋰源的LiVO2(003)峰的峰強明顯小于(104)峰,說明層狀結構發育不是很好,結構可能遭到破壞。可能是由于在球磨后,水浴蒸干后有氫氧化鋰析出導致,故如果使用球磨工藝技術,最好選擇使用Li2CO3為鋰源。
6 電化學性能測試
由本LiVO2實驗樣品制作的實驗電池的測試電壓范圍設置在1.0V~4.5V,倍率0.2C,標稱比容量設置為130mAh/g。圖4是其測試結果。
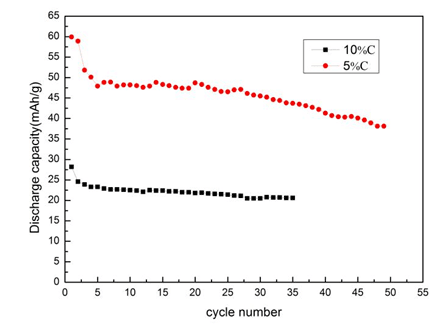
從圖中4可以明顯看出,碳含量越大,放電比容量越小,因為雖然碳包覆能夠增加復合材料的導電性,但是過厚的碳包覆層會阻礙Li+的擴散,增加鋰離子的擴散路徑,影響鋰離子的脫嵌,并且碳是非活性物質在充放電過程中對容量并沒有貢獻,所以碳含量的增加,活性物質的含量就相對來說減小。所以在碳包覆的過程中,碳包覆的量會極大影響材料的電化學性能,因此碳含量需要適量的減小。
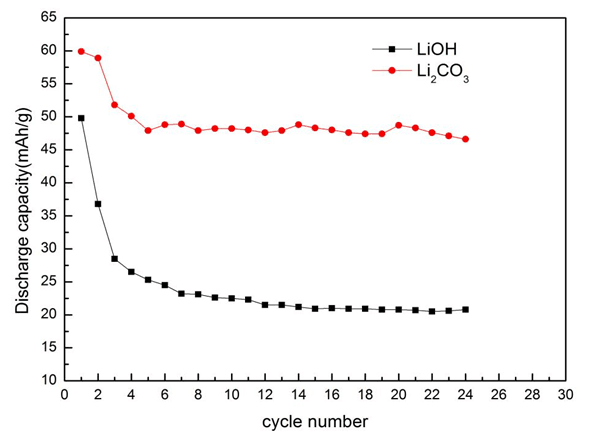
從圖中5可以看出,當以Li2CO3為鋰源時,放電比容量明顯高于LiOH為鋰源;與XRD衍射結果標準相對應,LiVO2材料層狀結構越好的物質放電比容量越高。LiOH的性能差可能是由于在球磨后,水浴蒸干后有氫氧化鋰析出導致,故如果使用球磨工藝技術,最好選擇使用Li2CO3為鋰源。
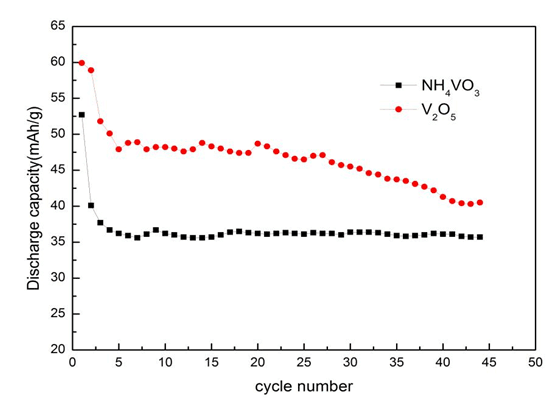
從圖中6可以發現以V2O5為釩源制備的LiVO2樣品的放電比容量更高,可能是由于NH4VO3分解后的產物V2O5活性不夠高導致,因此,最佳釩源選擇V2O5。
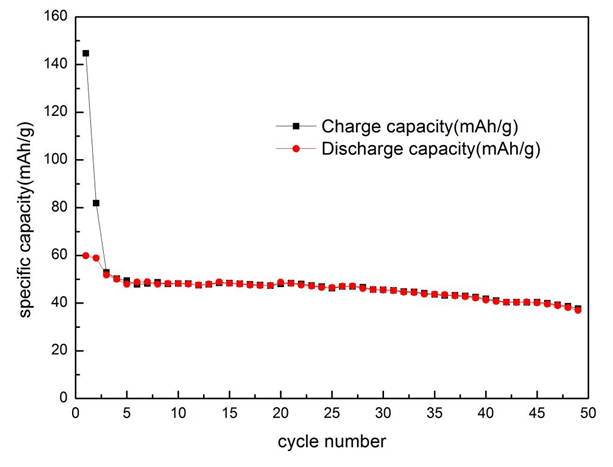
材料樣品組分為,Li2CO3(1.05mol)、V2O5(1.0mol)、蔗糖(1.05/12mol);制備工藝:球磨2h,水浴蒸干,真空干燥,500°預燒5小時,然后720°高溫燒結12小時,研磨成為細粉。
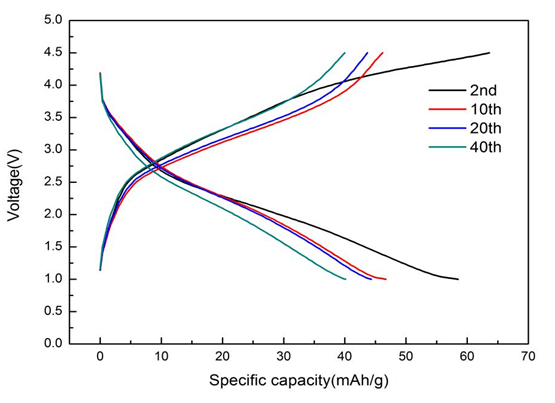
從圖8中可以看出,隨著循環次數的增加,電壓平臺基本沒有變化,說明材料的穩定性較好,其原因可能是碳包覆抑制了活性物質和電解質溶液之間的副反應,穩定了材料的層狀結構。比容量逐漸衰減下降,也可能是由于碳包覆層過后阻礙了鋰離子的擴散,以及在充放電過程中由于V離子占據鋰離子空位導致的陽離子混排,引起的結構相變導致了容量降低。
參考文獻:
ADDIN EN.REFLIST 1.J. M. Gaudet, J. R. Dahn. Lattice constant anomaly in the Li1+xV1–xO2 system near x=0. Canadian Journal of Physics. 2013,91(5):444-9.
2.B. G?dziorowski, J. Tobola, A. Braun, et al. Impact of crystal structure singularity on transport and electrochemical properties of Lix(LiyFezV1?y?z)O2— electrode material for lithium batteries. Functional Materials Letters. 2016,09(04):1641006.
3.V. V. Kulish, D. Koch, S. Manzhos. Ab initio study of Li, Mg and Al insertion into rutile VO2: fast diffusion and enhanced voltages for multivalent batteries. Physical chemistry chemical physics : PCCP. 2017,19(33):22538-45.
4.X. Li. Rhombohedral-structured LiVO2 Prepared by a Novel Two- Step Method and Its Electrochemical Properties. International Journal of Electrochemical Science. 2017:693-8.
5.K. Ozawa, Y. Nakao, L. Wang, et al. Structural modifications caused by electrochemical lithium extraction for two types of layered LiVO2 (R3-m). Journal of Power Sources. 2007,174(2):469-72.
6.K. Ozawa, L. Wang, H. Fujii, et al. Preparation and Electrochemical Properties of the Layered Material of LixVyO2 (x=0.86 and y=0.8). Journal of The Electrochemical Society. 2006,153(1):A117.
7. P. M. Panchmatia, A. R. Armstrong, P. G. Bruce, et al. Lithium-ion diffusion mechanisms in the battery anode material Li1+xV1-xO2. Physical chemistry chemical physics : PCCP. 2014,16(39):21114-8.
8.F. Pourpoint, X. Hua, D. S. Middlemiss, et al. New Insights into the Crystal and Electronic Structures of Li1+xV1–xO2 from Solid State NMR, Pair Distribution Function Analyses, and First Principles Calculations. Chemistry of Materials. 2012,24(15):2880-93.
9.W. Tian, M. F. Chisholm, P. G. Khalifah, et al. Single crystal growth and characterization of nearly stoichiometric LiVO2. Materials Research Bulletin. 2004,39(9):1319-28.
10.I. Tsuyumoto, Y. Nakakura, S. Yamaki, et al. Nanosized-Layered LiVO2 Prepared from Peroxo-Polyvanadic Acid and Its Electrochemical Properties. Journal of the American Ceramic Society. 2014,97(11):3374-7.
11.N. Yabuuchi, M. Takeuchi, S. Komaba, et al. Synthesis and electrochemical properties of Li(1.3)Nb(0.3)V(0.4)O2 as a positive electrode material for rechargeable lithium batteries. Chemical communications. 2016,52(10):2051-4.
12.W. Zhang, J. Luo, X. Li, et al. Facile synthesis and electrochemistry of a new cubic rock-salt LixVyO2 (x = 0.78, y = 0.75) electrode material. Journal of Materials Chemistry A. 2017,5(10):5148-55.
13.Y.-C. K. Chen-Wiegart, P. Shearing, Q. Yuan, et al. 3D morphological evolution of Li-ion battery negative electrode LiVO2 during oxidation using X-ray nano-tomography. Electrochemistry Communications. 2012,21:58-61.
14.M. Dhariwal, T. Maitra, I. Singh, et al. Orbital order in NaTiO2: A first principles study. Solid State Communications. 2012,152(20):1912-6.
15.B. G?dziorowski, ?. Kondracki, K. ?wierczek, et al. Structural and transport properties of Li1+xV1?xO2 anode materials for Li-ion batteries. Solid State Ionics. 2014,262:124-7.
16.X. Ma, G. Hautier, A. Jain, et al. Improved Capacity Retention for LiVO2 by Cr Substitution. Journal of the Electrochemical Society. 2012,160(2):A279-A84.
17.J. Liu. B-doped Li3V2(PO4)3/C cathode material with high rate capability for lithium-ion batteries. Ceramics International. 2017,43(2):2573-8.
18.Y. Li, K. Xiang, C. Shi, et al. Frog egg-like Li3V2(PO4)3 /carbon composite with three dimensional porous structure and its improved electrochemical performance in lithium ion batteries. Materials Letters. 2017,204:104-7.
19.S. Zhong, W. Hong, X. Zhang, et al. Synthesis of xLiVPO4F·yLi3V2(PO4)3/C composite as a potential cathode material for Li-ion batteries. Ionics. 2016,23(4):813-9.
20.M. Yang, M. Ren, W. Zhu, et al. Li3V2(PO4)3/graphene nanocomposites with superior cycling performance as cathode materials for lithium ion batteries. Electrochimica Acta. 2015,182:1046-52.


