尖晶石型5V鋰離子電池正極材料LiMn1.5Ni0.5O4的研究進展
鋰電世界訊,目前已經大規模生產并商業化應用的鋰離子電池正極材料仍然是LiCoO2,但社會的進步將會對鋰離子電池提出更高的要求,比如:環境友好、成本低、安全性能好、高能量密度、高功率密度和優良循環性能等,顯然LiCoO2已經不能滿足社會的需要。鋰離子電池的發展機遇與挑戰并存,而且一直是近十年來的研究熱點[1~4]。目前,鋰離子電池正極材料正處于快速發展階段,層狀結構、尖晶石結構及橄欖石結構的正極材料是鋰離子電池正極材料的主要研究領域。目前被業界看好的鋰離子電池正極材料主要有LiCoO2、LiNi0.8Co0.2O2、LiMn2O4、LiNi1/3Co1/3Mn1/3O2、LiFePO4等,但這些正極材料的放電電壓平臺都小于4V,要獲得高電壓,就必須將多個單電池串聯起來,就會出現維護不便,安全性不好的問題,這必然會影響到電池的功率密度和能量密度。而具有低成本, 環境友好, 安全性好等優點的LiMn2O4的放電電壓雖有4.1V[5,6],但由于存在Jahn-Teller效應,故它的充放電容量以及循環穩定性都不理想。
研究者發現當向LiMn2O4摻入少量的過渡金屬離子時,即LiMxMn2-xO4( M = Co、Cr、Fe、Cu、Ni)所獲得的材料不僅存在4V平臺,而且在5V附近也存在一個平臺。其中,4V平臺對應著Mn3+/ Mn4+電對的氧化-還原過程,而5V附近的平臺對應過渡金屬離子M2+/ M3+、M2+/ M4+或M3+/ M4+電對的氧化-還原過程,這些電對對應的氧化還原電位如表1所示。結合有關個氧化還原電對的相對能級圖可以給5V正極材料的篩選提供有益的理論指導[47]。
表1 各種過渡金屬離子電對的氧化還原電位(金屬鋰為負極)
| 電對 | Mn4+/Mn5+ | Co3+/Co4+ | Fe3+/Fe4+ | Cu2+/Cu3+ | Cr3+/Cr4+ | Ni2+/Ni4+ |
| 電位/V | 5.1 | 5.0 | 4.9 | 4.9 | 4.8 | 4.7 |
隨著低價態過渡金屬離子(M2+或M3+)摻雜量的增加,LiMxMn2-xO4中的Mn的平均價態也逐漸增加,即Mn3+的相對量減少,從而Mn3+/ Mn4+對應的4V平臺也減少,5V附近的平臺則相應地增加。理論上,當Mn3+完全消失時,4V平臺也就沒有了,LiMxMn2-xO4的充放電曲線則表現為單一的5V附近的平臺,對應的化合物為: LiCoMnO4、LiCrMnO4、LiFeMnO4、LiCu0.5Mn1.5O4、LiNi0.5Mn1.5O4。在這些尖晶石結構型化合物中,LiNi0.5Mn1.5O4的研究是最多的,它表現出最好的電化學性能。由于在Li+的嵌入和脫出過程中不存在Mn3+/Mn4+的氧化-還原,只存在Ni2+/Ni4+的氧化-還原,故不會產生Jahn-Teller畸變效應以及晶體結構變化,只有4.7V的放電平臺,放電容量可達理論容量(146.7 mAhg-1)的90%以上,循環穩定性也較好[7~11]。所以LiNi0.5Mn1.5O4具有高功率、高能量密度的優點,再加上它的成本低、環境友好、安全性好等優勢,使其在與常規正極材料的競爭中優勢明顯,并有望成為能量儲備器件和動力電池的最佳正極材料之一。本文就最近幾年來關于尖晶石型LiNi0.5Mn1.5O4正極材料的結構、合成及修飾改性等研究進展進行評述。
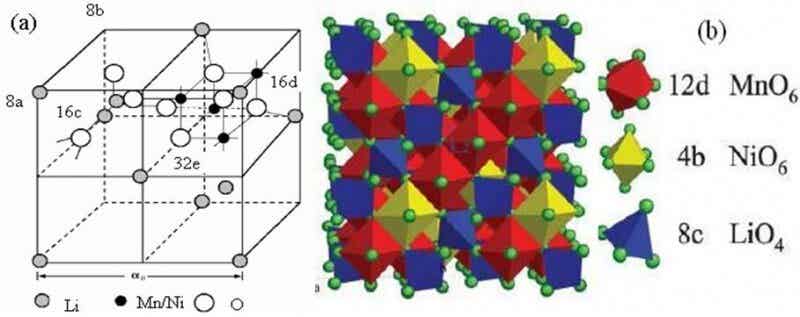
1 LiNi0.5Mn1.5O4正極材料的結構
尖晶石型LiNi0.5Mn1.5O4為立方晶型,存在二個空間群結構: Fd3m和P4332結構。在Fd3m結構中,Ni無序地取代部分Mn原子,都占據16d位;而在P4332結構中,Ni有序的取代了部分Mn的原子,16d位分為4b位和12d位,Ni占據4b位,Mn占據12d位。一般認為,Fd3m結構的LiNi0.5Mn1.5O4的電化學性能要比P4332結構的好,這主要與在充放過程中鋰離子的擴散路徑以及電子傳導率有關[12],而退火處理可以使Fd3m結構中的少量Mn3+變成Mn4+,從而轉變為P4332結構。圖1為尖晶石型LiNi0.5Mn1.5O4的結構示意圖。
2 LiNi0.5Mn1.5O4的合成方法
正極材料的電化學性能是由它的物質組成、結構與制備工藝決定的,故選擇適當的原料和制備工藝是制備具有優良電化學性能LiNi0.5Mn1.5O4正極材料的關鍵。目前合成LiNi0.5Mn1.5O4的主要方法有固相球磨法、共沉淀法、Sol-gel法、噴霧熱解法和熔鹽法等。
2.1 固相球磨法
固相反應法具有設備和工藝簡單、制備條件容易控制以及易于工業化生產等優點,是目前大規模生產鋰離子電池正極材料的主要方法。固相反應法制備LiNi0.5Mn1.5O4正極材料,一般是以Ni、Mn的氯化物[13,14]、氧化物[15]、硝酸鹽或醋酸鹽[16,17]和硝酸鋰、醋酸鋰或碳酸鋰為起始原料,經球磨后再高溫燒結,從而制備出LiNi0.5Mn1.5O4正極材料。采用固相反應法制備LiNi0.5Mn1.5O4卻不容易克服比如晶粒尺寸過大、形貌不規則、晶粒尺寸分布太寬等缺點,并且當合成溫度過高時,容易產生NiO或LixNi1-xO等雜相,合成單相LiNi0.5Mn1.5O4比較困難。
Chen等[17]以Ni(NO3)2?6H2O、MnO2 和Li2CO3為原料,以無水乙醇為分散介質,分別球磨和手工研磨5-12h,再將干燥后的研磨產物在750℃煅燒6-24h,得到了LiNi0.5Mn1.5O4正極材料,考察了不同的Ni源對LiNi0.5Mn1.5O4電化學性能的影響。XRD分析表明,只有當Ni源為Ni(NO3)2?6H2O時,才能夠制備出不含有任何雜相的LiNi0.5Mn1.5O4,而Ni源為Ni(CH3COO)2?6H2O, NiO 或Ni2O3時,都會出現NiO雜相。而以手工研磨的前驅物制備的樣品則含有更多的NiO雜相。電化學測試表明,以Ni(NO3)2?6H2O為Ni源,并以球磨的方式制備前驅物,制備的樣品的首次放電容量高達145 mAhg-1,循環10次后仍高達142 mAhg-1。
SUN等[14]以MnCl2?4H2O、NiCl2?6H2O和(NH4)2C2O4?H2O為原料,采用固相法制備了LiNi0.5Mn1.5O4正極材料。結果表明:提高燒結溫度或延長燒結時間可以改善晶粒的結晶度和形貌,在800℃燒結6h制備的樣品的電化學性能最好,當充放電倍率為0.2C時,放電容量為136 mAhg-1,而在5C放電倍率循環30次后,容量還高達101 mAhg-1。
2.2 共沉淀法
共沉淀法是指在溶液中含有至少兩種陽離子,它們均勻分布于溶液中,經沉淀反應后,可得到各種成分均一的沉淀。共沉淀法是制備鋰離子電池正極材料的重要方法之一。共沉淀法制備LiNi0.5Mn1.5O4正極材料時,一般是以Ni、Mn的氯化物[18]、醋酸鹽[19]、硝酸鹽[20,21]、硫酸鹽[22]為原料,以碳酸鹽、氫氧化物、草酸等為沉淀劑,制備出沉淀后再與鋰鹽混合均勻,然后再煅燒制備出產物。共沉淀法工藝簡單,通過改變共沉淀工藝條件能夠調控最終產物的粒徑分布以及形貌,能夠制備出高電化學性能的LiNi0.5Mn1.5O4正極材料。但在共沉淀過程中,卻難于保證各種金屬離子的沉淀速率一致,不易實現各組分在分子水平上的均勻分布,而且制備出鎳和錳的沉淀后,往往是再通過球磨的方式將沉淀與鋰鹽混合,所以也不容易實現鋰鹽和沉淀混合均勻。
Fang等[18]以NiCl2?6H2O、MnCl2?4H2O為原料,氨水為沉淀劑,采用共沉淀法制備了LiNi0.5Mn1.5O4正極材料。研究表明:制備的樣品為單一的尖晶石結構,沒有雜質成分;晶粒為八面體形貌,大約為2um;樣品經300次循環后放電容量保持率為83%,表現出優越的循環性能;Li+的擴散系數在4.1V平臺處為5.94×10-11 cm2 s-1,而在4.75V和4.86V處分別為4.35×10-10 cm2 s-1和7.0×10-10 cm2 s-1;退火處理過的樣品在300次循環后晶格參數a減少了0.42%,而未退火處理的樣品則減少了0.54%;首次證實了Ni和Mn不僅會溶解在電解液中,而且還會進一步沉積在負極表面上。
Liu等[19]以乙酸鹽為原料、草酸為沉淀劑,采用共沉淀法制備了LiNi0.5Mn1.5O4正極材料。研究結果表明:900℃燒結24h制備的樣品表現出優越的電化學性能。雜相LixNi1?xO的存在導致少許Mn3+存在于晶相中,故充放電曲線上有少許的4.1V的平臺。當充電截止電壓大于4.9V時,可能會導致電解液分解而使其性能下降。當充電截止電壓為4.8V時,0.2C放電容量為130mAhg-1,并在50次循環后容量沒有衰減。當放電倍率為2C和5C時,容量急劇下降,但10C循環50次后再以0.1C充放電,容量又恢復到了134mAhg-1。
2.3 Sol-gel法
Sol-gel法由于能夠實現各原料組分在原子級水平上的均勻分布,故是制備鋰離子電池正極材料LiNi0.5Mn1.5O4的常用方法之一[23~27]。一般來說,由于各組分均勻分布,在固相反應中各組分的擴散路徑較短,故煅燒溫度相對較低,煅燒的時間也相對較短,制備的產物顆粒細小,分布均勻,結晶性能好,初始容量較高,循環性能較好,但該方法工藝較復雜,成本較高,不利于實現工業化生產。
Sun等[23]以Sol-gel法合成了LiNi0.5Mn1.5O4正極材料。研究表明:相比傳統合成方法,采用超聲波輔助的Sol-gel法對于合成顆粒大小均一的正極材料更有效;在850℃合成的樣品具有最好的電化學性能,0.2C倍率放電容量達134.5mAhg-1,50次循環后容量保持率為96.2%;當燒結溫度提高時,雜相明顯增加,4V放電平臺也增大。
Hwang等[24]以LiCH3COO?2H2O,Mn(CH3COO)2?4H2O,Ni(CH3COO)2?4H2O為原料,檸檬酸為螯合劑,采用Sol-gel法分別在700℃,750℃,800℃和850℃制備出了尖晶石型結構Li1.02Ni0.5Mn1.5O4。研究結果表明:樣品的電化學性能嚴重依賴樣品的結晶度、顆粒大小和顆粒尺寸分布,而合適的燒結溫度和燒結時間是取得適當的結晶度、顆粒大小和顆粒尺寸分布的關鍵。800℃和850℃合成的樣品在25℃的環境溫度及0.1C和0.5C的充放電倍率條件下的比容量最高,循環穩定性最好。800℃合成的樣品在55℃高溫條件下表現出優良的倍率性能,而850℃合成的樣品的容量和循環穩定性都很差,這可能是因為在850℃合成的樣品的晶粒尺寸過大以及氧缺陷過多的緣故。
2.4 噴霧法
噴霧法[28~32]制備 LiNi0.5Mn1.5O4的一般步驟是將鋰、鎳和錳的醋酸鹽或硝酸鹽等可溶性原料配成混合溶液,再用噴霧器具將溶液噴成霧狀,而后再根據原料的構成配比以及溫度等條件可選擇干燥、熱解或燃燒等方式制備出最終樣品。
Li等[28]以LiOH?H2O,Ni(NO3)2?6H2O和Mn(CH3COO)2?4H2O為原料,采用噴霧干燥法制備出前驅體,然后高溫煅燒制備出最終樣品。研究結果表明,在氧氣中退火不僅能夠減少樣品中Mn3+的含量,而且能夠提高放電容量以及倍率特性;樣品的循環性能與在循環過程中發生的晶相轉變之間有極大的關系。
Park等[29]以LiNO3、Ni(NO3)2 ?H2O和Mn(NO3)2?4H2O為起始原料,按Li/Ni/Mn= 1.06:0.5:1.5的摩爾配比,溶于去離子水中,再將配好的溶液加入不斷攪拌的檸檬酸溶液中,并以氨水調節pH值,通過超聲波噴霧形成氣溶膠,氣溶膠干燥后,分別在不同的溫度下燒結從而制備出最終樣品LiNi0.5Mn1.5O4。研究結果表明: 900℃燒結制備的樣品在循環過程中沒有明顯的容量衰減,循環40次后容量保持率超過99%,容量還保持在135 mAhg-1以上,而750℃和800℃燒結的樣品的容量在40次循環后則分別衰減到119mAhg-1和125mAhg-1。
2.5 熔鹽法
熔鹽法[10,33,34]一般是以氯化物等為熔鹽,在一定溫度下熔鹽變為融熔態,成為反應介質,能極大的提高參與反應的離子的擴散速度,并在液相中實現各組分在原子水平上的均勻混合,使得反應具有一定的液相反應特征,將固-固反應轉化為固-液反應。
熔鹽法的優點在于操作比較簡單, 但由于煅燒溫度一般比較高, 能耗較大, 阻礙了其實際應用。
Kim等[10]采用熔鹽法, 將LiOH、Ni(OH)2 和γ-MnOOH 以化學計量比混合均勻, 再按不同的摩爾比與LiCl 混合, 分別在700℃~1000℃范圍內煅燒, 然后冷卻至室溫, 分別用去離子水和酒精洗滌除去殘留的鋰鹽, 干燥后得到最終產物。研究表明:煅燒氣氛必須控制恰當,過多的或過少的氧氣都會造成雜相生成;與固相法相比,熔鹽法更容易制備出單一的尖晶石結構;隨著LiCl量的增加,產物顆粒變大,分布范圍變窄;隨著煅燒溫度的提高和時間的延長,產物晶粒變大,產物的結晶度提高。900 ℃煅燒3 h制備的樣品的初始放電容量為139mAhg-1,50次循環后容量保持率仍為99%。
Wen[34]等人采用熔鹽法,首先用KMnO4和MnSO4制備出球狀MnO2,按化學計量比稱取LiOH、Ni(OH)2,再與過量的NaCl和KCl研磨1h,然后800℃下焙燒12h,產物用去離子水洗凈殘留的Na、K、Cl。研究表明:MnSO4溶液的pH值影響合成的MnO2的形貌和顆粒大小,當pH控制在0.1時,合成了表面光滑的球狀顆粒MnO2。由于原料在液態的熔鹽中反應,故反應物具有更高的擴散率,有利于制備出不含有任何雜質的尖晶石結構LiNi0.5Mn1.5O4;分別以商業生產的MnO2和自制的球狀MnO2為起始原料制備出LiNi0.5Mn1.5O4,在室溫下以1C的放電倍率進行充放電,其首次充放電容量分別為125mAhg-1和120mAhg-1、135mAhg-1和129mAhg-1,循環50次后的容量保持率分別為90.1%和98.6%。
3 LiNi0.5Mn1.5O4 的摻雜和表面包覆
3.1 LiNi0.5Mn1.5O4的摻雜
摻雜主要是用Fe、Cu、Cr、Co等活性金屬離子[35~38]或者Ti、Mg、A1等非活性金屬離子[39-40]取代部分Ni、Mn,用S、F等陰離子[9, 30]取代部分的O,以起到提高材料的放電容量和循環性能并改善充放電平臺的單一性等方面的作用。
Aklalouch等[35]以蔗糖輔助燃燒法合成了LiCr2YNi0.5?YMn1.5?YO4 (0<Y≤0.2)。研究表明:Cr3+無序地取代Ni2+和Mn3+的位置;煅燒溫度對最終樣品的結構和成分并沒有較大的影響;晶粒大小依賴于煅燒溫度而不是摻Cr3+量;合成條件對材料樣品的放電容量(約130mAhg-1)的影響不明顯,但對其循環性能的影響較大;900℃合成的摻雜樣品正極材料LiCr2YNi0.5?YMn1.5?YO4 (Y< 0.1),在50℃下循環時,其首次放電容量高達140 mAhg-1, 40次循環后容量保持率仍為96%。
Park等[36]研究了不同的摻Cr量對LiNi0.5Mn1.5O4電化學性能的影響。研究表明:隨著摻Cr量的增加,LiNi0.5Mn1.5O4的首次放電容量和循環穩定性都得到了改善。作者認為這是因為Cr與O的結合能比Ni和O的高,可以減少高溫煅燒時的氧缺失,并提高了結構的穩定性;摻Cr能夠降低Mn3+的含量,減少了4V平臺,從而增加了5V的放電平臺和容量,沒有摻雜的 LiNi0.5Mn1.5O4的首次放電容量是128.67 mAhg?1,50次循環后容量保持率為92℅,而LiNi0.5?xMn1.5CrxO4 (x = 0.05)的首次放電容量和50次循環后的容量保持率分別提高到137mAhg?1 和97.5%。
Lafont等[39]采用固相法合成了LiMg0.05Ni0.45Mn1.5O4。研究結果表明,樣品的C/10倍率放電容量為131 mAhg-1,5C倍率放電容量為90 mAhg-1。室溫下樣品材料的電導率為10-6Scm-1,Mg2+摻雜有助于保持結構在高倍率充放電中的穩定性。
3.2 LiNi0.5Mn1.5O4的表面包覆
LiNi0.5Mn1.5O4具有高達4.7V的充放電平臺,極易引起電解液的氧化還原反應,必然降低鋰離子電池的電化學性能,而表面包覆可以避免或減少正極材料與電解液的直接接觸,從而減少電解液的分解。目前,主要的包覆物有ZnO[41, 42]、ZrO2[43] 、SiO2[44]、Bi2O3[45] 、BiOF[46]等。
Wu等人[43]分別以ZrO2和ZrP2O7包覆LiNi0.5Mn1.5O4。研究結果表明:以ZrO2包覆的樣品顯著地提高了循環穩定性,在55℃下循環150次后容量保持率為96%,而沒有包覆的樣品和以ZrP2O7包覆的樣品容量保持率卻分別只有73%和80%。DSC分析也表明包覆能顯著提高樣品的熱穩定性。ZrO2包覆的樣品表現出的優越的電化學性能可能是因為致密、大小均一納米氧化鋯微粒有效地阻止了正極材料與電解液的反應,抑制了電解液反應活性的降低,也就抑制了正極與電解液的界面電阻的增加,從而提高了循環穩定性。
Kang等人[46]研究了BiOF包覆LiNi0.5Mn1.5O4在55℃的電化學性能。研究結果表明:BiOF包覆層的厚度為10nm,該包覆層能夠防止HF對正極材料的侵蝕,也能抑制Ni和Mn溶解于電解液中,所以表面包覆BiOF能極大提高正極材料的循環穩定性。BiOF包覆的樣品在55℃下循環70次后容量保持率為84.5%,而未包覆的樣品保持率則僅為31.3%。可見包覆的效果是很明顯的。
4 結語
LiNi0.5Mn1.5O4 正極材料具有唯一并高達4.7V的充放電平臺等優點,有望成為能量儲備器件和動力電池的最佳正極材料之一。從近幾年已發表的文獻來看,LiNi0.5Mn1.5O4正極材料的研究從2006年開始進入快速發展階段,LiNi0.5Mn1.5O4 正極材料的合成、改性和商品化應用研究已取得了較大的進展,許多方法都能夠制備出電化學性能優異的LiNi0.5Mn1.5O4正極材料。隨著5V正極材料的耐高電壓電解液問題的基本解決,目前困繞LiNi0.5Mn1.5O4的發展則主要是如何低成本大規模生產的問題,這還需要廣大科研工作者共同努力,繼續尋找一種操作簡便、成本低廉、環境友好的大規模生產方法,并進一步提高LiNi0.5Mn1.5O4 正極材料的電化學性能。
參考文獻
[1] M. Armand, J.-M. Tarascon. Researchers must find a sustainable way of providing the power our modern lifestyles demand [J]. Building better batteries, Nature, 2008, 451: 652–657
[2] J. Hassoun, P. Reale, B. Scrosati. Recent advances in liquid and polymer lithium-ion batteries [J]. J. Mater. Chem., 2007, 17: 3668–3677
[3] A.K. Shukla, T.P. Kumar. Materials for next-generation lithium batteries [J]. Curr. Sci., 2008, 94: 314–331
[4] Jeffrey W. Fergus. Recent developments in cathode materials for lithium ion batteries [J]. Journal of Power Sources, 2010, 195: 939–954
[5] D.H. Jang,Y.J. Shin, S.M. Oh. Dissolution of spinel oxides and capacity losses in 4V Li/LixMn2O4 cells [J]. J. Electrochem. Soc., 1996, 143: 2204–2211
[6] Y. Xia, Y. Zhou, M. Yoshio. Capacity Fading on Cycling of 4 V Li/LiMn2O4 Cells [J]. J. Electrochem. Soc., 1997, 144: 2593–2600
[7] M. Kunduraci, J.F. Al-Sharab, G.G. Amatucci. High-Power Nanostructured LiMn2-xNixO4 High-Voltage Lithium-Ion Battery Electrode Materials: Electrochemical Impact of Electronic Conductivity and Morphology [J]. Chem. Mater., 2006, 18: 3585–3592
[8] H.Y. Xu, S. Xie, N. Ding, et al. Improvement of electrochemical properties of LiNi0.5Mn1.5O4 spinel prepared by radiated polymer gel method [J]. Electrochimica Acta 51 (2006) 4352–4357.
[9] X.X. Xu, J. Yang, Y.Q. Wang, et al. LiNi0.5Mn1.5O3.975F0.05 as novel 5 V cathode material [J]. Journal of Power Sources 174 (2007) 1113–1116.
[10] J.-H. Kim, S.-T. Myung, Y.-K. Sun. Molten salt synthesis of LiNi0.5Mn1.5O4 spinel for 5 V class cathode material of Li-ion secondary battery [J]. Electrochimica Acta 49 (2004) 219–227.
[11] Yanyan Sun, Yifu Yang, Hui Zhan. Synthesis of high power type LiMn1.5Ni0.5O4 by optimizing its preparation conditions [J]. Journal of Power Sources 195(2010) 4322–4326.
[12] Kim J H, Yooh C S ,Myung S T. Phase transitions in Li1-δNi0.5Mn1.5O4 during cycling at 5V [J]. Electrochem Solid-State Lett. 2004,7(7):A216-A220.
[13] Haisheng Fang, Liping Li, Guangshe Li. A low-temperature reaction route to high rate and high
(陳炳,蔡宇,王震偉,劉珊珊,譚銘,熊偉強,張真,劉興泉)
(電子科技大學微電子與固體電子學院,四川成都,610054)
(電子薄膜與集成器件國家重點實驗室,四川成都,610054)
(電子科技大學新能源材料與集成能源器件研發中心,四川成都,610054)


