橄欖石型鋰離子電池正極材料磷酸鐵鋰和磷酸錳鋰的研究進展
1 前言
鋰電世界訊,自J.B.Goodenough [1] 等人于1997年首次報道了化合物LiMPO4 (M = Mn, Fe)可作為鋰離子電池正極材料以來,對該類化合物的研究就一直未能停止。該類化合物具有合成原材料豐富、生產成本低、無毒、環保、結構穩定、熱穩定性好、常溫電化學性能優良等特點,因而獲得了迅速發展,目前已經進入商業化生產。但是,因為LiMPO4 (M = Mn, Fe)材料自身離子電導率和電子電導率低,因此造成LiMPO4 (M = Mn, Fe)材料放電倍率性能很差,而且循環性能不佳。同時由于LiFePO4的嵌脫鋰電位較低,因而導致LiFePO4充放電電壓平臺較低,僅為3.4V(vs Li/Li+),其理論放電比容量為170mAh/g。但是在低溫下放電比容量更低,實際比容量最高只能達到110mAh/g。LiMnPO4的嵌脫鋰電位較高,因而其充放電電壓平臺較高,充放電平臺電壓為4.1V(vs Li/Li+),但是其離子電導率更低,因而放電比容量也低,而且電壓電勢下降很快。后續研究發現在固相法生產LiMPO4類材料過程中,存在著材料的振實密度較低,批次的一致性差等問題。針對該材料特點,許多學者對其進行了多方面的改性研究。
2 LiFePO4的改性研究
2.1 前驅體優化及金屬元素摻雜改性
Hong-Qiang[2]等以非離子型表面活性劑(吐溫40)作為添加劑,葡萄糖作為碳源,前驅體中加入添加劑,干燥后 N2保護下加熱煅燒(三個煅燒溫度研究點:680,720,750℃),合成得到實驗樣品。
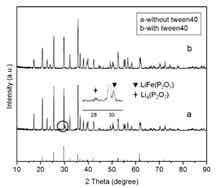
對比分析XRD圖譜,a曲線多出2個微小的寄生峰,兩個曲線其余峰形一致,峰形顯示表面活性劑并不影響LiFePO4晶體的形成,但是阻止了合成轉化過程中中間產物的產生。該寄生峰推論為LiFePO4在高溫轉化過程中的中間產物焦磷酸鋰(Li4P2O7)和焦磷酸鐵鋰(LiFeP2O7)的物相。

SEM圖譜分析表明:(1)隨著煅燒溫度的升高,晶體顆粒尺寸增大,團聚現象增加;(2)在同樣溫度下,含有表面活性劑樣品的晶體顆粒尺寸小于無活性劑樣品的晶體顆粒尺寸,且顆粒團聚度呈現同樣的變化規律,如表1所示。
表1 兩種樣品的粒子特性數據
| 樣品性質 | 有吐溫40樣品 | 無吐溫40樣品 | ||||
|---|---|---|---|---|---|---|
| 680℃ | 720℃ | 750℃ | 680℃ | 720℃ | 750℃ | |
| 平均晶體尺寸(nm) | 31 | 34 | 38 | 36 | 44 | 54 |
| 粒徑范圍 (nm) | 60-100 | 60-150 | 80-200 | 100-280 | 120-350 | 120-800 |
| 平均粒子尺寸(nm) | 70 | 110 | 160 | 180 | 300 | 500 |
| C含量(wt%) | 1.5 | 1.5 | 1.4 | 1.5 | 1.5 | 1.5 |
前驅體添加活性劑后合成的正極材料粒子特性良好,電化學性能測試數據優異(見表2),更能滿足鋰離子電池對于材料的要求。性能改善的原因:活性劑在高溫熱解中有助于C包覆層均勻,促使樣品材料顆粒尺寸一致性較好,團聚度減小,提升材料的電化學性能。
表2 兩種樣品不同倍率下的電化學容量以及低溫(-20℃)電化學容量
| 樣品類型 | 0.1C | 0.5C | 1C | 5C | 0.1C(-20℃) |
|---|---|---|---|---|---|
| 有吐溫40 | 163.6mAh/g | 156.8mAh/g | 142.7mAh/g | 121.6mAh/g | 131.3mAh/g |
| 無吐溫40 | 137.5mAh/g | 126.3mAh/g | 110.2mAh/g | 96.6mAh/g | <40mAh/g |
ZHAO Nannan[3]等采用固相法合成了鈰離子(Ce3+)摻雜的LiFePO4/C正極材料,并對樣品進行理化分析和電化學性能測試。
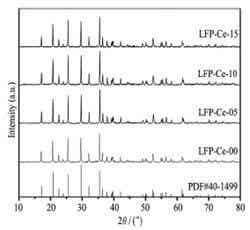
樣品的XRD圖譜如圖3所示,從XRD圖譜可以看出,摻雜鈰離子并沒有在XRD的峰形中出現雜峰,表明摻雜金屬元素并不影響LiFePO4/C晶體的形成,而是完全進入了LiFePO4/C的晶格中。
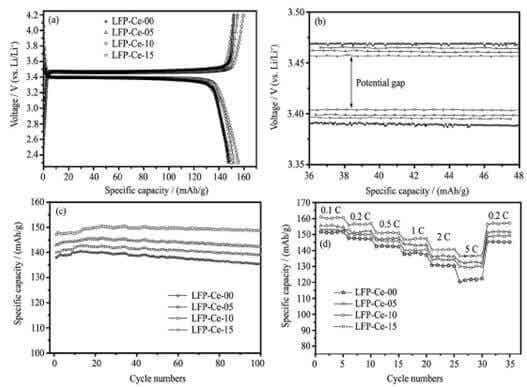
樣品電化學性能測試數據見圖4,從圖譜數據得知摻雜修飾后的材料電化學性能明顯優于未摻雜樣品的電化學性能。研究得出摻雜金屬離子提高材料的電子傳導率,提升了鋰離子的擴散通道,從而整體提高了材料的電化學性能。
倪江鋒[4]等用機械球磨和共沉淀兩種方法合成Cr3+摻雜的LiFePO4材料,并對合成后的化合物進行了XRD,SEM等理化表征和電化學性能測試。對比純LiFePO4,摻雜后的LiFePO4化合物電化學性能得到很大的改善,充放電比容量可達到144mAh/g和158mAh/g,大于未摻雜的純LiFePO4。
鐘美娥[5]等加入Mn鹽對化合物LiFePO4進行摻雜,對摻雜后的樣品進行了理化特征分析和電化學性能測試,測試結果發現碳包覆和少量 Mn2+一起摻雜的樣品,可以有效地提高 LiFePO4材料的電子電導率和鋰離子擴散速率,從而提高了充放電容量。許多研究者[6-13]都對Mn離子摻雜LiFePO4材料的影響和電化學性能進行了研究。
Qiao-Ying Huang[14]等采用固相法合成了以下系列化合物:LiMnPO4/C、LiMn0.85Fe0.15PO4/C以及LiMn0.92Ti0.08PO4/C和Fe、Ti聯合摻雜化合物:Li(Mn0.85Fe0.15)0.92Ti0.08PO4/C,應用XRD和SEM等對樣品理化特征進行了分析。XRD研究表明Ti離子和Fe離子與LMP形成了固溶體。由于Ti、Fe離子的離子半徑小于Mn離子半徑,所以摻雜金屬元素能減小合成樣品的粒子半徑,有利于鋰離子的擴散,尤其當Ti-Fe聯合摻雜時,粒子半徑變化更明顯,電化學性能測試數據如圖5所示。
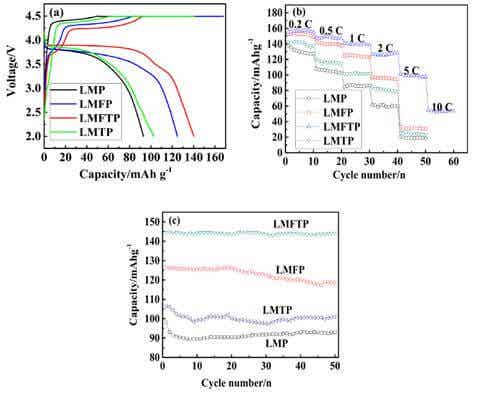
結合充放電曲線、倍率性能曲線和循環性能數據,從圖5中不難看出采用Fe-Ti聯合摻雜的化合物電化學性能得到較大改善,電容量、倍率特性和循環性能都有大幅度提高。
莊大高等[15]研究了水熱法合成LiFePO4化合物,并采用快速冷卻工藝合成,并對合成后的化合物的電化學性能進行了測試。同時研究了Mn、Ni、Co三種金屬元素摻雜的LiFePO4/C化合物,通過進行樣品的結構表征和電化學測試,研究了金屬元素的最佳摻雜量。結果顯示Co摻雜未能明顯提高實驗樣品的電化學性能;Ni摻雜能明顯提高實驗樣品的電化學循環穩定性:1C倍率條件下放電比容量為130 mAh/g,充放電循環100次后,容量沒有減少;Mn摻雜能改善實驗樣品的比容量性能。研究了在水熱法前驅體中摻雜Nb5+離子,并高溫固相合成樣品,樣品進行電化學性能測試,含Nb5+ 1.0%(mol)的摻雜化合物樣品在0.1C倍率時,電容量148 mAh/g,2C倍率時,電化學比容量能達到132 mAh/g。結果表明:部分摻雜少量的金屬元素能改善樣品的電化學性能。
SUN Yu-Heng[16]等采用固相法合成Ti摻雜LiFe0.95Ti0.05PO4的化合物,并用XRD、FTIR、SEM等對樣品進行理化表征和電化學性能測試, 在1C倍率下循環20次后,樣品容量能保持69%,而未摻雜化合物僅能保持33.6%,測試結果顯示摻雜后的樣品電化學循環穩定性更好,充放電比容量明顯提升。
LianLiang Wang[17]等合成了Ag摻雜的LiFePO4/C化合物,前驅體合成中,Ag(NH3)2OH和葡萄糖溶于溶液成混合溶液參與反應。樣品測試結果顯示Ag粒子成功嵌入LiFePO4/C中形成固溶體,并影響樣品晶體顆粒形態。電化學性能測試顯示,樣品的容量可以達到141.3 mAh/g,在1C倍率時循環800次容量幾乎不衰減,表明Ag摻雜的化合物具有優異的充放電循環性能。
2.2合成方法改性
Kwang Joo Kim[18]、K. Rajammal[19]等采用溶膠凝膠法,以醋酸鹽為原料,先合成凝膠前驅體,前驅體再經過700℃、6h的熱處理,得到化合物樣品。
樣品A:LiCoxMn2-xO4 ( x = 0.1, 0.3 ),XRD測試表明,Co摻雜和純LiMn2O4的晶體結構相同,表明:Co和Mn形成完全固溶體LiCoxMn2-xO4。SEM顯示:溶膠凝膠法合成的樣品顆粒的粒徑分布范圍窄,顆粒尺寸大小一致,粒子形態均一性好。兩種摻雜化合物LiCo0.1Mn1.9O4、LiCo0.3Mn1.7O4與LiMn2O4材料相比,經過100次以上的充放電循環后,含Co摻雜化合物電池的電化學循環性能良好。
樣品B:LiMn1-xAl0.5xCu0.5xPO4 ( x = 0.0、 0.1,、0.2),XRD測試表明,Al、Cu摻雜金屬離子不改變原化合物晶體結構,但摻雜金屬粒子引起原化合物的粒子半徑大小變動,與純LiMnPO4的XRD譜圖對比發現,相應的衍射峰位移變化。SEM和TEM測試顯示,Al、Cu摻雜的化合物(X = 0.1時)粒子尺寸最小,碳包覆均勻。電化學性能測試表明,聯合摻雜化合物(X = 0.1時)的電化學特性最好。K. Rajammal[19]等分析認為Al離子的存在能提高電子遷移速率,減弱姜-泰勒效應;Cu離子能穩定晶體結構,兩種金屬離子聯合摻雜效應能提高電子傳導率并能降低電子移動的電阻。
J. Chen等[20]采用水熱法合成了系列正極材料:LiFePO4/C、LiMnPO4/C、LiFexMn1-xPO4/C、LiFexNi1-xPO4/C等樣品,對樣品的理化特征和電化學性質進行表征和測試,結果表明:兩種金屬摻雜形成的化合物粒子形態一致性較好,C包覆更均勻,電化學性能更加優異。ZHOU Min等[21]也用水熱法合成LiFePO4化合物,并對樣品的理化特征和電化學性能進行測試,測試數據顯示樣品密度可以超出1.4 g/cm3,比容量能達到150 mAh/g(0.5C倍率時)。水熱法具有合成簡單,合成費用低,同時測試表明采用該方法合成鋰離子電池正極材料是可行的。
Arun Kumar[22]等采用固相法合成純LiFePO4和LiFePO4/C兩種化合物,并對兩種化合物的結構和電化學特性進行對比研究。研究發現C包覆能有效的控制LiFePO4粒子尺寸大小,能幫助Fe2+/Fe3+之間氧化還原的電子轉移,電化學特性研究發現純LFP樣品循環25次容量下降31%,LiFePO4/C樣品循環50次后容量下降僅3%,兩份樣品在C/5、 C/3和 C/2倍率時,對應的容量分別為63、43、13mAh/g和163、144、118mAh/g,從數據看出,C包覆大幅度提升了材料的電化學性能。
Z. Xu[23]等采用微乳液合成方法合成了LiFePO4/C正極材料,并對其理化特征和電化學性能進行了測試。TEM測試顯示顆粒形態基本一致,顆粒團聚程度較小,C包覆均勻,厚度基本一致。電化學測試結果表明微乳液法合成的材料具有優異的充放電容量和循環性能。研究認為這些性能得到提升的原因是因為微乳液法在合成過程中更好的控制了顆粒的增長速度和顆粒形態變化,阻止了顆粒的團聚,并有利于C均勻包覆在顆粒表面,從而改善了顆粒的導電性和電化學性能。
H.-C. Kang[24]等用球磨法合成了LiFePO4/C,并對合成樣品進行了分析和測試,研究了固相反應的最佳合成條件,通過樣品的合成和測試尋找最佳的球磨法反應條件。
Bang-Kun Zou[25]等人以抗壞血酸作為碳源,LiOH,Mn、Fe的硫酸鹽作為原料,H3PO4、乙二醇和去離子水混合溶液作溶劑,用溶劑熱法合成的LiMn0.4Fe0.6PO4前驅體,前驅體經180℃干燥10 h,分作兩份,分別加入0%和8%(重量比例)的葡萄糖作為聯合碳源,以固相法合成得到納米級顆粒的樣品,分別命名為D0-LMFP(含0%的葡萄糖)和D8-LMFP(含8%的葡萄糖)。再以相同步驟合成兩份不含抗壞血酸的樣品,分別為S0-LMFP(含0%的葡萄糖)和S8-LMFP(含8%的葡萄糖)。四種樣品用XRD、SEM、TEM測試,測試結果表明: D8-LMFP樣品顆粒尺寸數據分布最窄,粒子形態一致性最好,團聚度小,碳包覆厚度均勻度最好。
電化學性能測試結果見表3,數據顯示:D8-LMFP(即抗壞血酸和葡萄糖同時作為碳源)的化合物相對于其他三種化合物具有更優良的電容量性能和倍率特性,并且在-20℃時還能具有122.0 mAh/g的比容量,當溫度恢復到25℃時,電容量同時升到常溫時的容量。
表3 D8-LMFP和S8-LMFP的不同倍率下比容量數據(單位:mAh/g)
| 樣品\倍率 | 0.5C | 1C | 2C | 5C | 10C | 15C | 20C |
|---|---|---|---|---|---|---|---|
| D8-LMFP | 156.8 | 155.8 | 154.0 | 150.5 | 145.1 | 140.1 | 128.5 |
| S8-LMFP | 143.1 | 141.3 | 137.6 | 133.1 | 124.7 | 117.6 | 109.2 |
J. D. Wilcox[26]等研究了影響LiFePO4/C顆粒C包覆的因素。并對影響因素進行分析和總結,通過系列實驗獲取顆粒粒子C包覆的最佳條件。Y.-H. Huang[27]等用聚吡咯作為碳源,進行C包覆,并對包覆后的樣品進行結構表征和電化學性能測試,實驗結果顯示聚吡咯作為碳源,對化合物的電化學性能有較好的改善作用。
Kaipeng Wu[28]等采用綠色合成法:氧化還原-共沉淀的方法合成 (MnFe2O4/rGO)納米粒子前驅體,前驅體經球磨,熱處理后得到鋰離子電池正極復合材料LiMn1/3Fe2/3PO4/rGO/C,測試結果顯示:合成樣品的顆粒尺寸約在200nm左右,Fe-Mn完全形成固溶體 LiMn1/3Fe2/3PO4,并且在顆粒中分布均勻,石墨烯和包覆碳組成的包覆結構在顆粒表面包覆均勻。電化學測試樣品在20C倍率時具有94.8 mAh/g的放電比容量,充放電循環900次以后,容量僅下降6.25%,表明此復合材料具有優異的高倍率充放電容量和循環性能。
2.3其他改性研究
桑俊利[29]等對LiFePO4/C化合物的合成方法的改性進行了系統對比,列舉了高溫固相反應法、溶膠-凝膠法、微波合成法、水熱合成法和共沉淀法的合成研究和優缺點;說明了LiFePO4/C材料的分析手段和電化學的測試方法,比如:紅外光譜、掃描電鏡、X射線衍射和電化學性能研究等。
R.V. Apraksin[30]等研究正極材料LiFe0.4Mn0.6PO4與電極粘合劑的關系,用粘合劑(PEDOT : PSS / CMC)與傳統的粘合劑(PVDF)分別制作復合電極C-LFMP/PEDOT : PSS / CMC和C-LFMP/PVDF,實驗發現采用新型粘合劑制作成的電極的電化學性能優于傳統粘合劑制作的電極,實驗數據表明:0.2C和5C倍率的放電比容量140 mAh/g、130mAh/g,高于后者電極對應的放電容量:119 mAh/g、106 mAh/g。新型粘合劑是水溶劑型粘合劑,不僅能提升該正極材料的電化學性能;相比傳統粘合劑,還具有環保優勢。因此,水溶劑型粘合劑是未來值得進行改性研究的方向之一。
3 LiMnPO4的改性研究
Ye Hong[31]等通過改變原材料的添加次序、改變原材料比例的方式,用可控的合成方法合成了8份LiMnPO4樣品,并對樣品的理化特性、晶體常數和電化學性能進行測試。測試表明:當LiOH/H3PO4 的摩爾比為2.7或3.0,采用Mn-P-Li的原材料添加次序,合成出的化合物具有最好的電化學性能,10C倍率時容量為105 mAh/g,0.5C倍率下循環100次后的容量保持率可達93%。研究還發現,當LiOH過量的情況下,有利于樣品粒子尺寸的減小并能提升LiMnPO4的電化學性能。
寇立琴[32]等利用溶劑熱法合成LiMnPO4/C,在合成過程中用Sr2+離子摻雜得到LiMn1-xSrxPO4/C(x = 0、0.01、 0.03,、0.05)系列化合物樣品,樣品的理化特征,顆粒形貌用XRD、SEM、EIS等進行分析。電化學性能測試顯示,當x = 0.01時,樣品的電化學性能最好:0.1C倍率充放電循環50次后電容量能達到119.2 mA?h/g,循環保持率分別為 95.5%,相應地未摻雜樣品的循環保持率為85.1%。研究認為鍶離子摻雜穩定了材料的晶體結構,因此改善了電化學性能。
王永強[33]等利用水熱法,可控的合成了系列磷酸錳鋰微納米材料樣品(LiMnPO4),根據樣品的理化特性和電化學性能測試數據,獲得了最優的水熱法合成磷酸錳鋰(LiMnPO4)的合成工藝。并且研究發現Fe元素摻雜形成的固溶體,電化學性能提升更加明顯,結合水熱法合成的優點,有望在磷酸錳鋰(LiMnPO4)的制備研究中得到應用。
常曉燕[34]等采用固相法合成磷酸錳鋰材料樣品(LiMnPO4/C),主要研究合成溫度和球磨時間對產物制備的影響。研究發現中間產物和反應物的混合程度,燒結溫度的高低,都可以影響到磷酸錳鋰材料(LiMnPO4/C)的電化學性能。
朱彥榮[35]等采用計算方法研究了鋰離子電池正極材料LiMnPO4的電子結構,計算了該材料晶體的晶體結構,并且闡述了在電化學反應過程中,晶體內電子轉移和相應地結構變化情況。
楊新[36]等采用固相法合成了LiMnPO4/ C復合正極材料,以間苯二酚甲醛樹脂作為碳源,研究了固相反應的合成溫度和合成時間(燒結時間)對產物的影響,通過對樣品理化特征分析,顆粒形貌研究,電化學性能測試發現,在600℃燒結3h的樣品顆粒粒徑細小,顆粒形態較一致,C包覆均勻性好。電化學測試數據:0.2C倍率放電容量121.6 mAh/g,充放電循環20次后容量為110 mAh/g。結果顯示在固相法合成過程中,適當提高反應溫度并適當延長反應時間,可以有利于晶體結構改善,提高材料的電化學性能。
王志興[37]等以炭黑作為碳源,研究了固相反應合成法合成LiMnPO4/ C正極材料的影響因素,分析了合成溫度和反應時間對材料晶體結構完整性的影響,從而影響材料的電化學性能。
汪燕鳴[38]等用溶膠凝膠法合成了LiMnPO4/C材料,選擇月桂酸作為碳源,磷酸三丁酯作反應物和絡合物制備出樣品。并對樣品進行理化性質分析和電化學性能測試,研究顯示溶膠凝膠法有利于材料納米顆粒堆積成為多孔類球形大顆粒,并有助于提高材料振實密度和電化學性能,合成的樣品C包覆均勻,在55℃高溫和-10℃下具有優良的放電容量。
易惠華[39]等研究了LiMnPO4/C正極材料的制備,理化性質和電化學性能,主要進行了不同碳源的C包覆研究,Fe、Zn、Mg及三種金屬聯合摻雜對LiMnPO4/C材料的晶體結構、顆粒形態、電化學性能影響的研究。郭粉霞[40]等進行了不同合成方法(固相法、流變相法、水熱法)制備LiMnPO4/C正極材料的研究,進行了Fe、Co、V等摻雜制備LiMnPO4/C正極材料的研究,合成了Li3V2(PO4)3/C和LiCoPO4/C正極材料,對合成的樣品進行理化分析和顆粒研究,進行電化學性能測試。陳亞芳[41]等研究了固相法、水熱法、前驅體方法三種不同方法制備LiMnPO4/C正極材料,合成的樣品進行理化性質表征和電化學性能測試,對比了三種方法在制備材料過程中的優缺點,并總結了對材料電化學性能的影響。聶平[42]等進行LiMnPO4/C的溶劑熱制備法,Fe、Co金屬離子摻雜LiMnPO4/C制成復合正極材料以及復合材料LiMnPO4/MWCNT的研究,并測試了樣品電化學性能。
4 展望
聚陰離子磷酸鹽類正極材料的改性研究,許多學者已經進行了金屬摻雜改性(含多金屬的聯合摻雜)、不同碳源及多碳源聯合包覆(抗壞血酸、葡萄糖、石墨烯、月桂酸等)的研究、不同合成方法或者通過控制合成過程的改性研究等。
未來鋰離子電池正極材料電化學性能的改善,將采用多金屬復合摻雜并結合碳源包覆、前驅體改性等,向著復合型正極材料方向進行研究;或者是其他正極材料類的改性研究[43]。包括多元正極材料的研究,例如鋰硫化合物鋰離子電池材料[44],鈉硫化合物鈉離子電池材料[45],復合硅酸鹽類鋰離子電池材料[46-48] 等電極材料的研究等。
參考文獻:
[1]K. Padhi, K. S. Nanjundaswamy, and J. B. Goodenough. Phospho-olivines as Positive-Electrode Materials for Rechargeable Lithium Batteries. J. Electrochem. Soc, Vol. 144(4), 1997: 1188-1194
[2] Hong-Qiang Wang,Xiao-Hui Zhang,Feng-Hua Zheng. surfactant effect on synthesis of core-shell LiFePO4/C cathode materials for lithium-ion batteries. J Solid State Electrochem 2015,19:187-194
[3] ZHAO Nannan, LI Yongsheng, ZHI Xiaoke, etal. Effect of Ce3+ doping on the properties of LiFePO4 cathode material. JOURNAL OF RARE EARTHS, 34(2), 2016: 174-180
[4]倪江鋒,周恒輝,陳繼濤等,金屬氧化物摻雜改善LiFePO4電化學性能.無機化學學報,2005,21,4:472-476.
[5]鐘美娥,周震濤,林學好.橄欖石型 LiFePO4的摻錳改性研究.電池工業,2009,14(3):202-205
[6] Chung H T, Jang S K, Ryu H W, et al. Effects of nano-carbon webs on the electrochemical properties in LiFePO4/C composite [J]. Solid State Commun, 2004,131(8): 549-554.
[7] 常曉燕,王志興,李新海,等. 鋰離子蓄電池正極材料Li Mn1-xFexPO4的合成與性能 [J]. 電源技術, 2005, 29(10):644-647.
[8] 楊蓉,宋曉平,姚秉華,等. 正極材料磷酸亞鐵鋰的共沉淀合成和 Mn2+摻雜的研究[J]. 西安理工大學學報, 2006, 22(1): 82-84.
[9] 胡勤琴, 周震濤. Li Mn0.6Fe0.4PO4摻碳改性的研究 [J]. 電池,2007,37(1):38-40.
[10] Mi C H, Zhang X G, Zhao X B, et al. Synthesis andperformance of Li Mn0.6Fe0.4PO4/ nano -carbon [J]. MaterialsScience and Engineering B, 2006, 129: 8-13.
[11] Nakamura T, Sakumoto K, Okamoto M, et al. Electrochemicalstudy on Mn2+-substitution in Li Fe PO4olivine compound [J] .Journal of Power Sources, 2007, 174(2):435-441.
[12] Chang X Y, Wang Z X, Li X H, et al. Synthesis and performance of LiMn0.7Fe0.3PO4 cathode material for lithium ion batteries [J]. Materials Research Bulletin, 2005, 40:1513-1520.
[13] 宋士濤,鄧小川,孫建之,等.鋰離子電池正極材料Li(MnxFe1-x)PO4的合成及電化學性能的研究 [J]. 功能材料,2005, 36(12): 1941-1943.
[14]Qiao-Ying Huang, Zhi Wu, Jing Su, etal. Synthesis and electrochemical performance of Ti–Fe co-doped LiMn PO4/C as cathode material for lithium-ion batteries. Ceramics International 42 (2016) 11348–11354.
[15]莊大高,趙新兵. 鋰離子電池正極材料LiFePO4的合成及電化學性能的研究.浙江大學,2006.
[16]SUN Yu-Heng,LIU Dong-Qiang,YU Ji, et al, Synthesis and Electro-Chemical Properties of Ti-doped Non-stoichiometric LiFePO4 for Lithium-ion Battery Application. CHINESE JOURNAL OF INORGANIC CHEMISTRY, 2006,22 ,9:1711-1714
[17]LianLiang Wang,Pei Hua Ma,Kun Zhang, etal. Hydrothermal synthesis of silver embedded LiFePO4/C. J.Chil.Chem.Soc.55(2),2010:176-178
[18] Kwang Joo Kim*, Jung Han Lee, Tae Young Koh, etal. Improved cyclic stability by octahedral Co3+ substitution in spinel lithium manganese oxide thin-?lm cathode for rechargeable microbattery. Electrochimica Acta 200(2016) 84-89.
[19]K. Rajammal, D. Sivakumar, Navaneethan Duraisamy, et al. Structural and electrochemical characterizations of LiMn1-xAl0.5xCu0.5xPO4(x=0.0, 0.1, 0.2) cathode materials for lithium ion batteries. Materials Letters 173 (2016) 131-135.
[20] J. Chen, S. Wang, and M. S. Whittingham, “Hydro-thermal synthesis of cathode materials,” Journal of Power Sources.2007,174, 2: 442–448.
[21]ZHOU Min, QIAN Jiang Feng, CAO Yu Liang .et al. Low temperature hydrothermal synthesis and electrochemical performances of LiFePO4 microspheres as a cathode material for lithium-ion batteries. New Energy Materials, 2012, 57(32): 4164–4169
[22]Arun Kumar,R. Thomas,N. K. Karan,etal. Structural and Electrochemical Characterization of Pure LiFePO4 and Nanocomposite C-LiFePO4 Cathodes for Lithium Ion Rechargeable Batteries. Journal of Nanotechnology. 176517,2009:1-10.
[23] Z. Xu, L. Xu, Q. Lai, and X. Ji, Micro-emulsion synthesis of Li Fe PO4/C and its electrochemical properties as cathode materials for lithium-ion cells, Materials Chemistry and Physics, 2007,105,1: 80–85,.
[24] H.-C. Kang, D.-K. Jun, B. Jin, et al., Optimized solid-state synthesis of LiFePO4 cathode materials using ball-milling, Journal of Power Sources, 2008, 179(1):340–346,.
[25]Bang-Kun Zou, He-Yang Wang, Zi-Yue Qiang, etal. Mixed-carbon-coated LiMn0.4Fe0.6PO4 nanopowders with excellent high rate and low temperature performances for lithium-ion batteries. Electrochimica Acta:196(2016):377-385
[26] J. D. Wilcox, M. M. Doeff, M. Marcinek, and R. Kostecki, Factors influencing the quality of carbon coatings on LiFePO4, Journal of the Electrochemical Society, 2007,154, 5:389–395,.
[27] Y.-H. Huang, K.-S. Park, and J. B. Goodenough, Improving lithium batteries by tethering carbon-coated LiFePO4 to polypyrrole, Journal of the Electrochemical Society.2006,153, 12:2282–2286.
[28]Kaipeng Wu, Guorong Hu*, Zhongdong Peng, et al. In situ green synthesis of MnFe2O4 reduced grapheme oxide nano-composite and its usage for fabricating high-performance LiMn1/3Fe2/3PO4 reduced graphene oxide/carbon cathode material for Li-ion batteries. Electrochimica Acta 196 (2016):252–260.
[29]桑俊利, 王巧娟,郭西鳳.磷酸鐵鋰正極材料的合成與表征技術.無機鹽工業,2008,40(2):13-16
[30] R.V.Apraksin, S.N.Eliseeva, E.G.Tolstopjatova, et al. High-rate performance of LiFe0.4Mn0.6PO4 cathode materials with poly(3,4-ethylenedioxythiopene): Poly (styrene sulfonate)/carboxymethyl cellulose. Materials Letters 176 (2016) 248-252.
[31]Ye Hong, Zilong Tang, Wei Quan et al. Controllable synthesis of LiMnPO4 nanocrystals: Morphology evolution and their size-dependent electrochemical properties. Ceramics International 42 (2016) 8769–8778
[32] 寇立琴,陳芳杰,陳麗. 鍶摻雜 LiMnPO4/C 正極材料電化學性能的研究. 當代化工,2015,44,10:2286-2293.
[33] 王永強,章冬云,劉艷等. 磷酸錳鋰正極材料的可控合成與電化學性能研究. 上海應用技術學院學報(自然科學版), 2013,13,4:285-290.
[34]常曉燕,王志興,李新海等. 鋰離子電池正極材料 LiMnPO4的合成與性能.物理化學學報, 2004,20,10:1249-1252.
[35] 朱彥榮,謝穎,伊廷鋒等. 鋰離子電池正極材料 LiMnPO4/C的電子結構. 無機化學學報, 2013,29,3:523-527.
[36]楊新,劉學武,劉貴昌等. 鋰離子電池正極材料 LiMnPO4/C的合成研究.電化學,2011,17,3:306-311.
[37]王志興,李向群,常曉燕等. 鋰離子電池橄欖石結構正極材料 LiMnPO4的合成與性能.中國有色金屬學報, 2008,18,4:660-665.
[38]汪燕鳴,王飛,王廣健. 溶膠-凝膠法制備 LiMnPO4/C正極材料及其電化學性能. 無機材料學報, 2013,28,4:415-419.
[39]易惠華,戴永年,方海生. 鋰離子電池正極材料 LiMnPO4的制備及改性研究. 昆明理工大學, 2012.
[40]郭粉霞,張聯齊. 磷酸錳(鈷)鋰鋰離子電池正極材料.天津理工大學, 2014.
[41]陳亞芳,宋光森,王又容. 鋰離子電池正極材料磷酸錳鋰的合成及改性研究.武漢工業學院,2011.
[42] 聶平,張校剛. 鋰離子電池正極材料 LiMnPO4的制備及其電化學性能研究. 新疆大學, 2012.
[43]Tsutomu Ohzuku, Ralph J. Brodd. An overview of positive-electrode materials for advanced lithium-ion batteries. Journal of Power Sources, 2007, 174: 449–456
[44]Linda F. Nazar, Marine Cuisinier, Quan Pang. Lithium-sulfur batteries .Materials Research Society, 2014, 39:436-441
[45]Kei Kubota, Naoaki Yabuuchi ,Hiroaki Yoshida ,et al Layered oxides as positive electrode materials for Na-ion batteries. Materials Research Society, 2014, 39:416-422
[46]Mohammad Mahdi Kalantarian, Sirous Asgari, Doretta Capsoni, et al. An ab initio investigation of Li2M0.5N0.5SiO4(M, N = Mn, Fe, Co Ni) as Li-ion battery cathode materials. Phys. Chem. Chem. Phys, 2013, 15: 8035--8041
[47]Guang He, Guerman Popov, and Linda F. Nazar. Hydrothermal Synthesis and Electrochemical Properties of Li2CoSiO4/C Nanospheres Chem. Mater. 2013, 25:1024?1031
[48]Guohua Zhong,Yanling,Li,Peng Yan,et al. Structural, Electronic, and Electrochemical Properties of Cathode Materials Li2MSiO4(M=Mn, Fe, and Co): Density Functional Calculations. J. Phys. Chem. 2010, 114:3693–3700
(鐘萬1 張萍1 劉一町1 劉珊珊2 譚銘2 趙紅遠2 劉興泉1,2)
(1 四川富驊新能源科技有限公司 四川 綿陽 62100)
(2 電子科技大學新能源材料與器件研究中心 四川 成都 610054)


