鐵基正極材料LiFeO2的研究進(jìn)展
鋰離子電池電極材料LiFeO2具有原料資源豐富、環(huán)保性好和理論比容量高等特點(diǎn),應(yīng)用潛力巨大。本文綜述了LiFeO2材料的研究進(jìn)展,介紹了不同類型LiFeO2的結(jié)構(gòu)特點(diǎn)、合成方法和電化學(xué)性能等,介紹了LiFeO2正極材料的首次充放電反應(yīng)機(jī)理,介紹了LiFeO2作為負(fù)極材料的應(yīng)用,總結(jié)了對LiFeO2的改性方法,并展望了其未來可能的研究和發(fā)展方向。
基于巖鹽結(jié)構(gòu)的LiMO2(M=Co、Ni、NixMnyCo1-x-y等)型正極材料具有有序的α-NaFeO2型結(jié)構(gòu),電化學(xué)性能優(yōu)良,在鋰離子電池中具有廣泛應(yīng)用。但Co、Ni等金屬昂貴,使得其應(yīng)用受到限制。在人們不斷開發(fā)和研究廉價、低毒的新型正極材料的過程中,發(fā)現(xiàn)LiFeO2具有與LiCoO2相似的巖鹽結(jié)構(gòu),并給予廣泛關(guān)注。近年來,隨著許多新型制備方法和研究檢測手段的應(yīng)用,LiFeO2的制備、結(jié)構(gòu)、改性等方面的研究逐漸深入,展現(xiàn)了一定的商業(yè)化應(yīng)用價值。本文總結(jié)了LiFeO2的結(jié)構(gòu)、制備方法、電化學(xué)性能、摻雜改性等,并展望了其未來的發(fā)展方向和應(yīng)用前景?
1 LiFeO2的結(jié)構(gòu)和性能特點(diǎn)
根據(jù)合成方法的不同,LiFeO2有多種晶體結(jié)構(gòu)。α-LiFeO2 (Fm3m)[1-5]呈現(xiàn)陽離子無序的立方巖鹽結(jié)構(gòu);γ-LiFeO2 (I41/amd)[1]為陽離子有序的四方晶體結(jié)構(gòu),是Li+與Fe3+在八面體位的有序化導(dǎo)致對稱性由立方晶系降為四方晶系所致;β-LiFeO2 (C2/c) [1]是在上述有序化過程中形成的中間相;具有α-NaFeO2層狀結(jié)構(gòu)的LiFeO2 (R3m)[1,3,4],陽離子有序排列,Li+和Fe3+交替占據(jù)在有O2-立方密堆積形成的八面體空位;波紋層狀LiFeO2 (Pmnm)[6-8]屬于正交晶體結(jié)構(gòu),O2-呈面心立方密堆積排列,Li+和Fe3+對在陽離子層中交替排列;針鐵礦型LiFeO2[2,6]具有與α-FeOOH相似的正交晶體結(jié)構(gòu)(Pbnm);錳鋇礦型LiFeO2 [9]具有與β-FeOOH相似的四方晶體結(jié)構(gòu)(I4/m)?
通常,固相法合成得到的α- LiFeO2、β- LiFeO2和γ- LiFeO2不具有電化學(xué)活性?而經(jīng)研究發(fā)現(xiàn),具有電化學(xué)活性的LiFeO2具有如下特征:
(1) 具有獨(dú)特的首次充放電曲線(如圖1所示[10])?首次充電電壓平臺高于4V,對應(yīng)Fe3+/Fe4+氧化還原電對;首次放電時電壓突降至3V,且放電容量大于充電容量;隨后的充放電容量分布在1.5-3.5V區(qū)間?目前認(rèn)為導(dǎo)致該現(xiàn)象的原因有兩個:①首次充電時發(fā)生了結(jié)構(gòu)充足。Sakurai等[2,6]提出在首次充電是生成的Fe4+可能發(fā)揮了重要作用;而Kanno等[8]在研究波紋層狀LiFeO2的電性能時推測,在首次充電過程中發(fā)生了由波紋層狀相向非晶結(jié)構(gòu)相的轉(zhuǎn)變,之后的充放電是在非晶相LiFeO2中進(jìn)行的。Morals等[10,11]采用XRD研究了納米α- LiFeO2在首次充放電過程中的結(jié)構(gòu)變化,認(rèn)為鋰脫出后發(fā)生了結(jié)構(gòu)重組,由此推斷脫Li+時氧化形成的Fe4+從八面體的4a位遷移到四面體的8c位,阻擋了Li+的擴(kuò)散通道,使Li+的脫出量減少。②Fe4+很不穩(wěn)定,容易與電解液發(fā)生氧化還原反應(yīng),因此電極材料中只存在少量Fe4+。Guenne等[7]采用XRD和 Mossbauer譜分析了波紋層狀LiFeO2充放電過程中的結(jié)構(gòu)變化,發(fā)現(xiàn)充電時生成的Fe4+與電解液反應(yīng)還原為Fe3+,因此放電對應(yīng)于Fe3+/Fe2+氧化還原電對?Wu等[5]的原位XRD分析結(jié)果顯示,納米α- LiFeO2在充放電過程中保持了巖鹽結(jié)構(gòu),首輪充放電后電壓平臺為2.1~2.6V,對應(yīng)于Fe3+/Fe2+氧化還原對?Morales等[10]采用XPS分析也證實(shí)了Fe2+的存在,并在DSC測試中發(fā)現(xiàn)充電態(tài)樣品在398K處發(fā)生強(qiáng)放熱反應(yīng),可能是Fe4+與電解液反應(yīng)所致?
(2) 小粒徑和大比表面積?具有化學(xué)活性的α-LiFeO2?針鐵礦型LiFeO2?鋇錳礦型LiFeO2、波紋層狀LiFeO2都是納米材料?Wang等[12]認(rèn)為這歸因于比表面積的增加,加速了鋰離子的嵌入—脫出反應(yīng)?而Morales等[11]所制α- LiFeO2的粒徑約50nm且成串聚集,C/4倍率下的容量~150mAh/g,性能優(yōu)良,比納米棒狀α-LiFeO2的容量又高許多,這歸功于更小的粒徑和成串的形貌,為鋰離子傳輸提供了不間斷的通道?
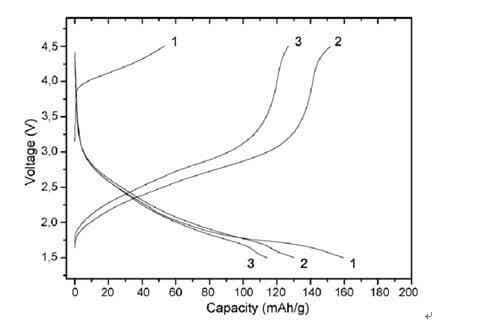
圖 1[10] Li/LiPF6(EC,DMC)/α- LiFeO2在C/8下前3次循環(huán)的充放電曲線
(3) 容量衰減較快,特別是在循環(huán)初期?這可能與循環(huán)過程中的材料相變有關(guān)。Lee等[13,14]應(yīng)用原位外XRD分析技術(shù),發(fā)現(xiàn)循環(huán)時由波紋層狀LiFeO2相向尖晶石相α-LiFeO2或β-LiFe5O8逐漸轉(zhuǎn)變,認(rèn)為這種相轉(zhuǎn)變可能是導(dǎo)致容量衰減的主要原因?而他們采用原位XRD和TEM進(jìn)行的研究表明[15],發(fā)現(xiàn)首輪循環(huán)時就開始向尖晶石相轉(zhuǎn)化,3周循環(huán)后所生成LiFe5O8相的含量與50周的已無明顯變化,說明相變過程在初始循環(huán)中即會顯著發(fā)生,這可能是LiFeO2循環(huán)初期容量衰減較快的原因?
2 LiFeO2的制備方法
研究發(fā)現(xiàn),不同晶體結(jié)構(gòu)的LiFeO2與合成條件密切相關(guān),最常用的有固相法[11,12,14, 16-17]和離子交換法[2,6,9,18-19]。
2.1 固相法
一般通過固相法(600℃以上)制備的LiFeO2是α-LiFeO2,不具有電化學(xué)活性,但是將其粒徑控制在納米級時,其具有較好的電化學(xué)性能。
Morals等[11]采用固相法獲得50nm的LiFeO2納米束,經(jīng)過50次循環(huán)后其容量為150mAh/g,認(rèn)為電極材料電化學(xué)性能的改善歸因于顆粒的尺寸效應(yīng),一方面是納米顆粒能減少Li+的擴(kuò)散距離,提高擴(kuò)散效率,另一方面是納米粒子具有較大比表面積,易于與電解液充分接觸,減小界面電阻,保證Li+快速脫嵌。Lee等[16]在200~800℃的溫度范圍合成了化合物LixFeyOz,XRD測試表明,在200℃時LixFeyOz是由α-LiFe5O8?β-LiFe5O8和少量的α-LiFeO2組成,電化學(xué)測試表明,在1.5~4.5V電壓范圍,該混合物的初始放電比容量達(dá)到了215mAh/g,經(jīng)過40次電化學(xué)循環(huán)后其容量保持率達(dá)到了95%?在800℃時得到單一相的α-LiFeO2,且在同樣的測試條件下其放電比容量只有5mAh/g?一方面是由于高溫時顆粒聚集比較嚴(yán)重,顆粒粒徑為700~800nm,低溫時顆粒分散則較好,粒徑只有100~200nm;另一方面是由于200℃時,混合物中的LiFe5O8在10次循環(huán)后形成了四面體型LiFeO2,而四面體型的LiFeO2可能在循環(huán)過程中起到結(jié)構(gòu)穩(wěn)定的作用。但是在循環(huán)過程中四面體型LiFeO2的形成和它與循環(huán)性能提高的關(guān)系仍在探索中。Wang等[12]采用低溫熔鹽法,以LiOH、LiNO3和β-FeOOH為原料,按照n(Li)/n(Fe)=4,在空氣氣氛下、250℃煅燒3h獲得直徑80nm、長度900nm的LiFeO2納米棒(如圖2所示),在2.0~4.5V電壓范圍內(nèi)的放電容量約為80mAh/g。
2.2 離子交換法
與傳統(tǒng)的固相法相比,離子交換反應(yīng)只需在較低的溫度(一般低于200℃)下進(jìn)行。具有電化學(xué)活性的α-LiFeO2、針鐵礦LiFeO2、錳鋇礦型LiFeO2、波紋狀LiFeO2都是在低溫下合成的。LiFeO2主要以LiOH和FeOOH為原料在醇溶液中反應(yīng)得到。
Kanno等[18]以LiOH?H2O和γ-FeOOH為原料,按不同的反應(yīng)條件得到波紋層狀LiFeO2,在1.5~3.5V電壓范圍放電比容量可達(dá)110mAh/g。XRD結(jié)果表明,循環(huán)后LiFeO2的衍射峰變寬,主要是由于電化學(xué)循環(huán)中生成的Fe4+形成了不穩(wěn)定的尖晶石相LiFe2O4,從而使晶格產(chǎn)生變化導(dǎo)致其非晶化,影響了Li+的脫嵌。Sakurai等[6]用相同的方法得到了波紋層狀LiFeO2和針鐵礦型LiFeO2,前者在1.5~4.5V的放電容量為110mAh/g,而后者僅只有60mAh/g。
Matasumura等[9]以LiOH?H2O和γ-FeOOH為原料,在2-乙氧基乙醇中合成了鋇錳礦型LiFeO2,在1.5~4.5V電壓范圍內(nèi)經(jīng)過多次循環(huán)后其放電容量仍保持在150mAh/g左右。鋇錳礦型LiFeO2結(jié)構(gòu)中的孔道為Li+的擴(kuò)散提供了良好的通道,保證其迅速脫嵌,使電極材料表現(xiàn)出良好的電化學(xué)性能。Hirayama等[20]利用α-NaFeO2為前驅(qū)體,采用離子交換法合成了平均粒徑為40~400nm的層狀巖鹽型LiFeO2。40nm和400nm的LiFeO2在2.0~4.5V范圍內(nèi),10mA/g的電流密度下分別擁有115mAh/g、80mAh/g的首次放電容量。分析表明,隨著粒徑減小,LiFeO2具有更好的電化學(xué)活性,這可能是由于陽離子混排引起的,TEM結(jié)果顯示在循環(huán)過程中,LiFeO2由層狀結(jié)構(gòu)轉(zhuǎn)變?yōu)榱⒎浇Y(jié)構(gòu),從而保證了電化學(xué)反應(yīng)的穩(wěn)定性。

圖 2 (a、b)分別為LiFeO2納米棒的FESEM和TEM圖[12];(c、e)分別為中空α-LiFeO2和α-LiFeO2/C的SEM圖[23];(d、f)分別為中空α-LiFeO2和α-LiFeO2/C的HRTEM圖[23]

2.3 其它方法
除了上述兩種常用的方法外,人們也嘗試和研究了其它制備方法。Suresh等[21]以LiNO3/NaNO3、Fe(COO)2?H2O為原料,采用溶液燃燒法分別制備了LiFeO2和α-NaFeO2,獲得的LiFeO2呈無定形相,電化學(xué)活性較差,首次放電容量僅為80mAh/g,而使用該方法獲得的α-NaFeO2經(jīng)離子交換法制備的層狀LiFeO2具有205mAh/g的首次放電容量。Morales等[11]采用低溫熔鹽法,把α-FeOOH、LiNO3和LiOH的鹽混合物(摩爾比為1∶2∶2)在空氣中250℃煅燒3h,得到α-LiFeO2正極材料,在1.5~4.5V范圍內(nèi)放電比容量達(dá)150mAh/g。Li等[22]利用溶劑熱法,以LiOH?H2O和自制的α-FeOOH為原料,在140℃下合成了α-LiFeO2,在1.5~4.5V電壓范圍內(nèi),表現(xiàn)出60mAh/g的穩(wěn)定的放電容量。
Büyükyazi等[23]使用靜電紡絲法制備了中空的α-LiFeO2纖維,材料具有尖晶石結(jié)構(gòu),且電化學(xué)活性極好。將其作為負(fù)極材料應(yīng)用在鋰離子電池中時,發(fā)現(xiàn)在0.1C、0.5-2.5V條件下50次循環(huán)后仍保持756mAh/g的放電容量,第2次到第50次循環(huán)的容量保持率為68%,特殊的網(wǎng)絡(luò)結(jié)構(gòu)和大的比表面積增加了活性物質(zhì)與電解質(zhì)的接觸面積,縮短了電子和Li+離子遷移的路徑,從而提高了材料的電化學(xué)性能。Liu等[24]采用流變相法,以Fe2O3和CH3COOLi?2H2O為原料合成了納米α-LiFeO2(100~300nm),XRD結(jié)果表明其具有很高的結(jié)晶度。在1.5~4.3V、0.1C的條件下首次放電容量達(dá)169mAh/g,從第10次到第50次循環(huán)間表現(xiàn)出了很高的容量保持率(96.8%),這些良好的電化學(xué)性能或得益于它的高結(jié)晶度。
3 LiFeO2的摻雜與改性
由于LiFeO2在循環(huán)過程中容易發(fā)生相變形成尖晶石相的LiFe5O8,導(dǎo)致容量衰減較快,因此許多研究小組通過摻入離子半徑和價態(tài)與Fe接近的Mn、Co和Ni等陽離子來改善其性能。隨著研究的深入,近年來也有人通過碳材料包覆、材料纖維化等手段來改善材料性能。
Suresh等[21]采用前驅(qū)體NaFe0.8Co0.1O2在正己醇中和過量的LiBr通過離子交換獲得層狀LiFe0.8Co0.1O2,在1.5~4.5V電壓范圍內(nèi)其初始放電容量為205mAh/g,30次循環(huán)后容量仍保持為190mAh/g,其良好的電化學(xué)性能或得益于Co對材料層狀結(jié)構(gòu)的穩(wěn)定作用。
Holzapfel等[25]以NaFexCo1-xO2為前驅(qū)體,與LiCl-LiNO3的共融混合物進(jìn)行離子交換得到具有層狀結(jié)構(gòu)的LiFexCo1-xO2,組分和結(jié)構(gòu)分析表明,所得產(chǎn)物中含有少量Na,經(jīng)存在約5% 的陽離子混排,主要表現(xiàn)為Fe占據(jù)Li位。電極材料的初始充放電容量隨著x的增大而減小,這是因?yàn)?span>Fe在Li位含量的增大會阻礙Li+的擴(kuò)散,而且LiFexCo1-xO2在循環(huán)過程中產(chǎn)生相變,層狀結(jié)構(gòu)變成三維立方結(jié)構(gòu),使Li+很難進(jìn)行脫嵌,充放電容量迅速降低,當(dāng)x≥0.6時,充放電容量小于10mAh/g。
Lee等[26]采用固相法合成了LiMnxFe1-xO2。XRD測試發(fā)現(xiàn),在350℃得到不同Mn含量的固溶體化合物LiFeO2-LixMnO2。電化學(xué)測試表明,當(dāng)LiFeO2中的Mn含量分別為10%、30%和50% 時,在室溫下1.5~4.5V范圍內(nèi)50次循環(huán)后放電容量分別為80mAh/g、110 mAh/g和158 mAh/g,說明Mn含量的增加能夠增加固溶體的可逆放電容量。
Zhang等[27]采用化學(xué)聚合法,以LiOH?H2O和自制的β-FeOOH為原料制備了表面包覆有聚吡咯層的納米α-LiFeO2-PPy,在1.5~4.5V、0.1C條件下循環(huán)100次后放電容量為104mAh/g,實(shí)驗(yàn)表明聚吡咯包覆層有效地提高了電池的可逆容量和循環(huán)穩(wěn)定性。
近年來,有人提出將LiFeO2作為鋰離子電池負(fù)極材料使用,經(jīng)改性后的材料具有優(yōu)良的電化學(xué)性能。Büyükyazi等[23]采用靜電紡絲的方法制備了中空的α-LiFeO2和碳包覆的α-LiFeO2/C納米纖維,纖維具有均勻的直徑和形貌(如圖2所示)。α-LiFeO2/C納米纖維在0.1C下循環(huán)50次后放電容量為821mAh/g,從第2次到第50次循環(huán)的容量保持了為75%,碳包覆層能夠起到增強(qiáng)α-LiFeO2的導(dǎo)電性以及穩(wěn)定結(jié)構(gòu)的作用。而中空的α-LiFeO2納米纖維在相同的情況下放電容量為756mAh/g,容量保持了為68%。Guo等[28]采用固相法合成了與多孔碳復(fù)合的α-LiFeO2/PC納米顆粒,納米α-LiFeO2顆粒位于多孔碳的表面或者孔內(nèi)部。α-LiFeO2/PC具有相當(dāng)高的首次放電比容量(1830mAh/g,0.1C),且循環(huán)120次后容量保持為792mAh/g;即使在1C的電流密度下循環(huán)120次后,容量仍有570mAh/g。Rahman等[29]采用熔鹽法合成了具有高比表面積(115.52 m2/g)的納米多孔α-LiFeO2-C復(fù)合物,在0.01~2.5V,1C下表現(xiàn)出很高的可逆比容量(540mAh/g,200次)。Krummacher等[30]采用離子交換法結(jié)合固相反應(yīng)法制備了碳包覆的α-LiFeO2納米顆粒,在1C、0.01~3.00V條件下循環(huán)50次后比容量為200mAh/g。Guo等[31]用固相法合成了γ-LiFeO2,在沒有碳包覆的情況下,0.01~3V、0.1C的首次放電容量達(dá)1055.3 mAh/g,循環(huán)50次后容量保持為611.5 mAh/g。但該材料作為負(fù)極材料的機(jī)理還不十分清楚,如果只是材料本身,不具有這么高的儲鋰能力。因此,很多基礎(chǔ)問題有待進(jìn)一步深入研究。
4 結(jié)束語
近年來,鐵基鋰離子電池(正、負(fù)極)電極材料,尤其是正極材料越來越受到國內(nèi)外研究小組的重視,與LiCoO2、LiNiO2相比,LiFeO2資源豐富、無污染、電性能好,應(yīng)用前景十分誘人,但目前的研究尚不成系統(tǒng),對材料結(jié)構(gòu)和性能的研究尚不成熟,因此未來的研究重點(diǎn)可從以下方面考慮:①深入對材料性能、結(jié)構(gòu)和它們之間關(guān)系的研究,進(jìn)一步探索材料在循環(huán)過程中容量衰減的機(jī)理;②不斷優(yōu)化制備工藝,尋找合成純相材料的最佳條件和方法;③尋求更優(yōu)化的摻雜和改性方法,平衡材料的首次放電容量和容量保持率之間的關(guān)系,另外,Al、Ni、Co等陽離子摻雜有利于穩(wěn)定結(jié)構(gòu),提高電化學(xué)性能;④設(shè)計(jì)與材料相匹配的高電壓電解液,減少Fe4+的還原量。當(dāng)然,也有課題組將其作為負(fù)極材料應(yīng)用在鋰離子電池中,并獲得了很好的電化學(xué)性能。
因此,探索新的制備方法,調(diào)整固溶體成分和比例,對材料進(jìn)行包覆和共混改進(jìn),是進(jìn)一步提高LiFeO2穩(wěn)定性和電化學(xué)性能研究的熱點(diǎn),開發(fā)其作為正極材料和負(fù)極材料的應(yīng)用是推動LiFeO2研究的有效手段。


