多元素共摻雜改性高電位鈷酸鋰的制備研究
鋰離子電池由于具有能量高、壽命長、質量輕、體積小等優點而備受關注[1-4]。其中,LiCoO2因其具有電壓高、放電平穩、制作工藝簡單等優點而被廣泛應用于商業化正極材料中。但是,工業生產中純的LiCoO2材料存在著容量較低,不耐高電壓充放電,鈷資源儲量不足等缺點[5-9]。針對這些缺點,通常采用摻雜的方法,通過引入雜質元素來取代Co元素,同時也不破壞LiCoO2的空間幾何結構,達到提高容量以及循環性能的目的。研究人員普遍采取的辦法是對LiCoO2摻雜金屬離子。有學者研究發現在純相LiCoO2中摻雜金屬Al元素能有效提高LiCoO2的電化學性能[10];然而,金屬Al的引入會引起LiCoO2容量的衰減[11]。研究發現Mg摻雜LiCoO2摻雜能使LiCoO2材料的熱穩定性能提高。通過第一性原理計算,發現Mg摻雜LiCoO2后,價帶出現電子態空穴,提高了電導率,并且擁有更好的熱穩定性能。Mg2+取代Co3+后材料在循環過程中的結構穩定性得以增強。另外,一部分Mg2+會取代Li+,這樣會阻止在循環過程中材料發生相變反應。
然而單純的Mg離子摻雜并不能改變充放電的截止電壓,因此需要考慮其它的摻雜元素。研究表明,在鋰離子正極材料中摻雜V會減小正極材料的晶胞體積,但晶胞參數c變大[12],從而有利于Li+的擴散,最終使材料的充放電比容量得到增加[13-15]。同時,V摻雜能使正極材料的充電平臺降低,放電平臺增高,減小材料的極化效應,從而使材料在高電位下具有更好的循環性能。
雖然在LiCoO2材料中陽離子摻雜得到了一定的改善效果,但在鈷酸鋰的陰離子摻雜方面,國內目前的研究文獻比較欠缺[16]。之所以選擇用氟元素作為摻雜元素,這是因為氟元素的電負性比氧大,氟取代氧后本身不會在材料的充放電過程中發生氧化還原變化,與鈷的成鍵會更強,有利于材料框架結構的穩定[17,18]。研究同時表明氟摻雜在正極材料中會形成氟氧化物,它能夠抵抗電解液中HF的侵蝕,從而提高循環穩定性[19]。本文采用高溫固相法對LiCoO2進行鎂,氟,釩共摻雜,制備了改性高電位鈷酸鋰正極材料,研究了其電化學性能,并重點考察了摻雜量對正極材料性能的影響。
2 實驗部分
2.1 樣品的制備
原料:碳酸鋰(Li2CO3,分析純, AR),四氧化三鈷(Co3O4,分析純,AR),五氧化二釩(V2O5,分析純,AR),六水合硝酸鎂(Mg(NO3)2.6H2O,分析純,AR),氟化鋰(LiF,分析純,AR)。
制備步驟:以Li:Co:Al:V:Mg:F按照一定的化學計量比稱量上述各原料;將上述幾種樣品粉末混合之后轉入球磨機(南京大學儀器廠生產的,QM-3SP2型行星式球磨機)中并加入適量酒精進行球磨,研磨時間為8小時,轉速為400r/min。球磨完成后,將混合的溶液取出于水浴鍋(北京市永光明醫療儀器廠生產的XMTD-4000型電熱恒溫水浴鍋)中烘干;將烘干后得到的混合粉末置于120?C的鼓風干燥箱(北京市永光明醫療儀器廠生產的101型電熱鼓風干燥箱)中烘干6小時;將得到的產物在馬弗爐中進行燒結。燒結條件為750?C燒結10小時,取出研磨之后再于920?C燒結10小時。自然冷卻后經過適當處理即得到目標正極材料。
2.2材料的電化學性能測試
電池的組裝:將活性物質?乙炔黑導電劑:PVDF粘結劑(溶劑為N-甲基吡咯烷酮NMP)按照85:10:5的比例混合。過程為,先將活性物質和乙炔黑混合,并研磨約20分鐘后迅速加入PVDF溶液并研磨至無明顯顆粒感,然后涂覆于鋁箔集流體上。將涂覆后的鋁箔放置于真空干燥箱中于105℃下烘干4~6h。之后在打孔器下打孔制成電極片。再次恒重后,在充滿氬氣的不銹鋼手套箱中組裝成扣式電池。
電化學性能測試:采用深圳新威爾電子有限公司生產的NEWWARE電池測試系統進行恒流充放電電化學性能測試。測試條件為,電壓范圍2.7~4.5V;電流倍率:0.5C、1C、2C、5C;測試溫度為室溫(22?3℃)。
2.3材料表征
采用Philips Pro MPD DY1291型X射線衍射儀(XRD)對樣品進行物相分析;采用JEOL的JSM-6380LA型掃描電鏡(SEM)對所合成的材料進行微觀形貌分析以及粒徑尺寸分布的研究。
3 結果與討論
3.1 V摻雜量為3%常溫下0.5C電化學性能對比研究
共制得以下3個樣品:
S1: 純相LiCoO2;
S2: 摻雜量為3%V,1%Mg,1%F的含摻雜元素的LiCoO2;
S3: 摻雜量為3%V,2%Mg,2%F的含摻雜元素的LiCoO2。
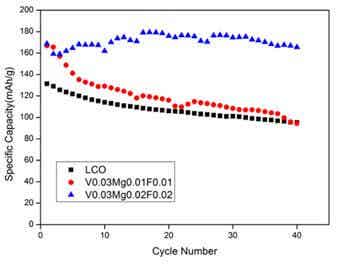
圖1為樣品S1、S2和S3循環40周放電比容量圖
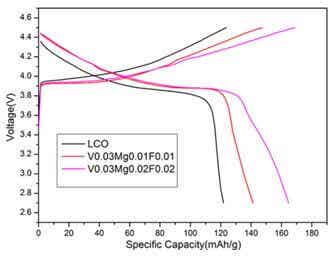
圖2為樣品S1、S2和S3的第5周的充放電曲線圖
表1 不同摻雜量對固相法制備材料的電化學性能對比
|
樣品編號 |
最大放電比容量(mAh/g) |
循環40周后放電比容量(mAh/g) |
容量保持率(%) |
|
S1 |
131.4 |
95.3 |
72.5 |
|
S2 |
166.8 |
94.4 |
56.6 |
|
S3 |
179.5 |
165.5 |
92.2 |
3.2 LiCo0.95V0.03Mg0.02O1.98F0.02的倍率性能
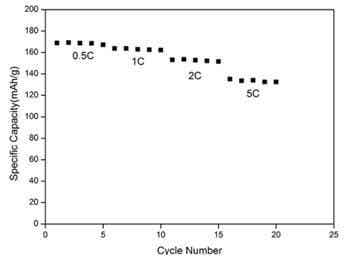
圖3 為LiCo0.95Mg0.02V0.03O1.98F0.02的倍率性能
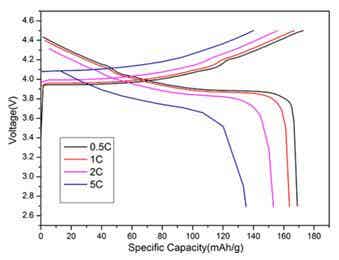
圖4 為LiCo0.95Mg0.02V0.03O1.98F0.02的倍率充放電曲線
圖3是燒結條件為750?C燒結10小時,取出研磨之后再在920?C燒結10小時的條件下合成的最佳樣品LiCo0.95Mg0.02V0.03O1.98F0.02的倍率性能曲線,分別進行了0.5C,1C,2C,5C的倍率性能測試。由圖3可知,在0.5C倍率測試條件下,樣品的放電比容量較高,超過了170mAh/g,但是隨著循環的深入,材料的容量有了一定程度的下降,在較大倍率2C以及5C倍率的測試條件下,材料的放電性能較之前有所下降,但仍然有150mAh/g和130mAh/g,容量的衰減可能是由于大倍率電流下,比容量受到了鋰離子擴散系數和速度的影響,造成了極化增大的緣故。值得一提的是,隨著循環的進行,材料的放電比容量略有一定程度的上升,這是由于鋰離子電池隨著循環的進行逐步活化的過程所致。
樣品在不同倍率測試的充放電曲線如圖4所示,其中在5C大倍率條件下樣品LiCo0.95Mg0.02V0.03O1.98F0.02的充放電曲線出現異常,充放電曲線有了一定的彎折而導致不光滑,充放電曲線的交叉點位置容量低于20mAh/g,電池極化現象變得嚴重。除了5C以外,其他倍率條件下的充放電曲線正常,充放電曲線光滑而不曲折,在0.5C較低倍率條件下,充放電極化很小,平臺電壓差距不大,曲線的交叉點更靠后,交叉點比容量約為70mAh/g,樣品體現了很好的電化學性能。隨著倍率提升到1C以及2C時,材料充放電電壓平臺差值有所增大,樣品的極化效應稍有增加,循環性能沒有0.5C倍率下平穩,但仍有不錯的充放電比容量。
3.3交流阻抗譜分析
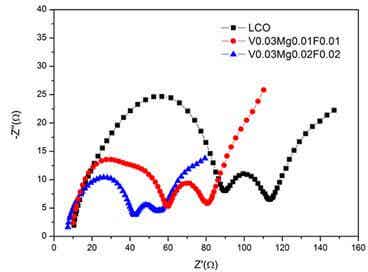
圖5為純相LCO以及摻雜后LCO材料的交流阻抗譜圖
將上述三種材料在常溫下循環5周后進行交流阻抗測試,其測試結果如圖5所示。不難看出,三種樣品的Nyquist曲線由三部分組成,其中在低頻區的直線或斜線代表的是材料的Warburg阻抗,它代表鋰離子的固態擴散;中頻區的半圓代表的是電荷轉移過程中形成的阻抗;而高頻區的半圓為鋰離子通過電極表面與電解液極化反應形成的SEI膜的阻抗,半圓越小代表Li+和電子在遷移過程中,所受到的阻力越小。從圖5中不難看出材料具有三種材料LCO,LiCo0.96Mg0.01V0.03O1.99F0.01和LiCo0.95Mg0.02V0.03O1.98F0.02的電荷轉移阻抗(第二個半圓右側最低點所在的位置)分別為113Ω, 80.6Ω,54.5Ω,其中LiCo0.95Mg0.02V0.03O1.98F0.02具有最小的電荷轉移阻抗,這也和該材料表現出最好的比容量和最好的循環性能完全相一致。
3.4 LiCo0.95Mg0.02V0.03O1.98F0.02的掃描電鏡圖

圖6 LiCo0.95Mg0.02V0.03O1.98F0.02的SEM圖
圖6是最佳樣品LiCo0.95Mg0.02V0.03O1.98F0.02的SEM圖,通過圖6可以看出所制得的材料均為大小均勻的塊狀結構,大小約為1微米左右,表面整齊。樣品顆粒小,Li+的遷移距離越短,這有利于提高材料的比容量和倍率性能。同時材料的結晶度較高,這意味著材料的結構更加完整,有利于Li+可逆脫嵌過程的順利進行。
3.5材料的XRD表征
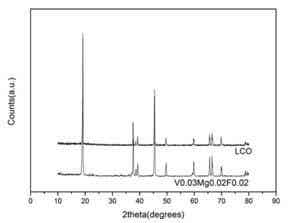
圖7 為材料的XRD圖譜
表2材料層狀結構的特征參數
|
樣品 |
c/a的比值 |
I(003)/I(104)的比值 |
|
LCO |
4.984 |
1.148 |
|
LiCo0.95Mg0.02V0.03O1.98F0.02 |
5.001 |
1.647 |
4. 結論
采用高溫固相法在燒結條件為750?C燒結10小時,之后再在920?C燒結10小時的條件下對LiCoO2進行了金屬V,Mg和非金屬F共摻雜改性,成功制得了具有α-NaFeO2層狀結構的高電壓鈷酸鋰正極材料。結果表明:正極材料LiCo0.95Mg0.02V0.03O1.98F0.02具有良好的層狀結構以及均勻的表面形貌,且具有最好的電化學性能。在室溫下2.7~4.5V電壓的范圍內,0.5C的倍率下最高可逆充放電比容量達到了179.5mAh/g,循環40周后仍有165.5 mAh/g的放電比容量,容量保持率達到92.2%,表現出較好的循環性能。經過倍率性能測試,材料在2C和5C的高倍率下仍然具有不錯的性能,初步具備了良好的應用前景。
5. 致謝
本項目得到四川省科技支撐計劃項目的資助及四川富驊新能源科技有限公司項目的資助,特此致謝。
四川省科技支撐計劃資助項目及四川富驊新能源科技有限公司資助項目。
聯系人:劉興泉教授,Lxquan@uestc.edu.cn
參考文獻
[1] 胡國榮, 桂陽海, 彭忠東. 鋰離子蓄電池正極材料LiCoO2研究進展 [J]. 電源技術, 2003, 27: 125—128.
[2] K. Mizushima, P.C. Jones, P.J. Wiseman, J.B. Goodenough. Mater. Res. Bull.[J] 15 (1980) 783.
[3] JENG E D , WON M S , SHIM Y B. Catholic properties of a lithium ion secondary battery using LiCoO2 prepared by a complex formation reaction[J]. J Power Sources, 1998 , 70( 1) : 70 —77.
[4] 吳川, 吳鋒, 陳實. 鋰離子蓄電池正極材料研究進展[J]. 電池, 2000, 30( 1) : 35—38.
[5] J.B. Goodenough. Electrochemical Energy Storage in a Substainable Modern Society[J]. Energy and Environmental Science[J]. 2013, 7(1): 14-18
[6] B. Scrosati. Challenge of Portable Power[J]. Nature. 1995, 373 (6515):557-558
[7] B. Xu, D. Qian, Z. Wang, et al..Recent Progress in Cathode Material Research for Advanced Lithium Ion Batteries[J]. Materials Science and Engineering: R: Reports. 2012, 73 (5-6): 51-56
[8] Bandhauer, T.; Garimella S; Fuller, T. J. Electrochem. Soc. 2011, 158, R1.
[9] B. Dunn, H. Kamath, J.M. Tarascon. Electrical Energy Storage for the Grid: A Battery of Choices[J]. Science. 2011, 334 (6058): 928-935
[10] G. Ceder, Y.M. Chiang, D.R. Sadoway, M.K. Aydinol, Y.I. Jang, B. Huang, Identification of cathode materials for lithium batteries guided by first-principles calculations[J]. Nature, 392 (1998) 694–696.
[11] P. Elumalai, H.N. Vasan, N. Munichandraiah. Microwave synthesis and electrochemical properties of LiCo1-xMxO2 (M = Al and Mg) cathodes for Li-ion rechargeable batteries[J]. J. Power Sources 125 (2004) 77–84.
[12] Ian D. Johnson a, Mechthild Lübke a, On Ying Wu, etc. Pilot-scale continuous synthesis of a vanadium-doped LiFePO4/C nano-composite high-rate cathodes for lithium-ion batteries[J]. Journal of Power Sources[J], 302 (2016) 410-418.
[13] J. Hong, C.S. Wang, X. Chen, S. Upreti, M.S. Whittingham. Electrochem. Solid State. Lett[J]. 12 (2009) A33-A38.
[14] F. Omenya, N. Chernova, S. Upreti, P.Y. Zavalij, K.-W. Nam, X.-Q. Yang, M. Whittingham. Chem. Mater[J]. 23 (2011) 4733-4740.
[15] K. Harrison, C. Bridges, M. Paranthaman, C. Segre, J. Katsoudas, V. Maroni, J. Idrobo, J. B. Goodenough, A. Manthiram. Chem. Mater[J]. 25 (2013) 768-781.
[16] Oh, S.W., Park, S.H., Kim, J.H., etc. Improvement of electrochemical properties of LiNi0.5Mn1.5O4 spinel material by fluorine substitution. Journal of Power Sources[J], 2006, 157: 464-470.
[17] Amatucci, G.G., Pereira, N., Zheng, T., etc. Enhancement of the electrochemical properties of LiMn2O4 through chemical substitution, Journal of Power Sources[J], 1999, 81-82: 39-43.
[18] Palacín, M.R., Amatucci, G.G., Anne, M., etc. Electrochemical and structural study of the 3.3V reduction step in defective LixMn2O4 and LiMn2O4-yFy compounds[J]. Journal of Power Sources, 1999, 81-82: 627-631.
[19] Amatucci G.G., Pereira N., Tarascon J.-M. Failure Mechanism and improvement of the elevated temperature cycling of LiMn2O4 compounds through the use of the LiAlzMn2-xO4-zFz solid solution, Journal of the Electrochemical Society, 2001, 148 (2): A171-A182.
(蔡宇1 譚銘1 劉珊珊1 王震偉1 趙紅遠1 劉興泉1,2)
(1 電子科技大學微電子與固體電子學院新能源材料與集成能源器件研發中心 四川成都 610054)
(2 四川富驊新能源科技有限公司 四川綿陽 621000)


